Capítulo 4
Biopsia de Próstata
- Dr. Eliú Pérez D. (1), Dr. Enzo Peña F (2)., Dr. Arturo Cerda V. (2), Dr. Eduardo Rojas C. (2)
- (1) Hospital de Ancud – (2) Hospital de Castro
La ecografía transrectal de la próstata (TRUS= de sus siglas en inglés) se ha convertido en una herramienta estándar en la práctica de la urología. Muchas intervenciones guiadas por imágenes son de utilidad en el cáncer de próstata, incluida la biopsia de próstata inicial, biopsia de seguimiento para vigilancia activa, braquiterapia de dosis baja y alta, crioterapia y el ultrasonido focalizado de alta intensidad, se basan en la ecografía transrectal de la próstata.
En la actualidad distintos procesos han sido introducidos gracias a esta herramienta, como colocación de marcadores fiduciales y de radiofrecuencia guiados por ecografía transrectal para el seguimiento tumoral en tiempo real de la próstata durante la radioterapia o la inyección de hidrogel de Polietileno-glicol en la grasa perirrectal anterior para disminuir la toxicidad rectal durante la radioterapia prostática, siendo otra aplicación muy nueva y en evolución(1-3). Sin embargo, este capítulo se centra principalmente en el uso más común de la ecografía transrectal, la biopsia de próstata para el diagnóstico del cáncer de próstata.
Cuando se toma la decisión de realizar una biopsia de próstata diagnóstica, la biopsia de próstata mediante TRUS de 12 muestras se considera la técnica estándar preferida actualmente(4).
La ecografía transrectal de la próstata fue descrita por primera vez por Watanabe y sus colegas en el año 1968. Hasta entonces, la biopsia de próstata era dirigida digitalmente. Esto fue común hasta finales de la década de 1980, cuando se expandió su uso clínico y evolucionó hacia biopsias de próstata dirigidas por ultrasonido.
Mejoras en la tecnología permitieron su continuo desarrollo con la importante introducción del protocolo de biopsia de seis muestras, descrito por Hodge y asociados(5). Luego la técnica aumentó a 12 muestras. Este desarrollo junto al screening con PSA, aumentó el número de hombres sometidos a detección temprana de cáncer de próstata.
Las estimaciones actuales indican que se realizan hasta 1.3 millones de biopsias anualmente solo en los Estados Unidos(6). Dado la prevalencia de cáncer de próstata clínicamente significativo e insignificante y la frecuencia con la que las biopsias de próstata guiadas por ultrasonido son realizadas, se han centrado esfuerzos significativos en determinar las indicaciones apropiadas para biopsia, la técnica ideal, junto a cómo limitar mejor las complicaciones.
Técnicas
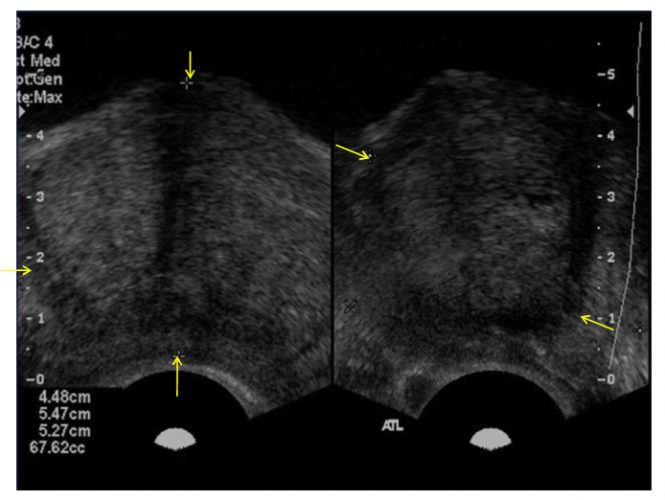
La evaluación completa de la próstata incluye exploración tanto en el plano sagital como en el transversal para obtener el cálculo del volumen. La zona central y la zona periférica se inspeccionan para detectar lesiones hipoecoicas y anormalidades del contorno. Las vesículas seminales y los vasos deferentes deben ser completamente visualizados.

Los pacientes generalmente se ubican en posición decúbito lateral izquierdo para examinar tanto los planos transversales como longitudinales.
Para obtener imágenes transversales, se va avanzando la sonda cefálicamente a través del recto obteniendo imágenes desde la base de la próstata, las vesículas seminales y el cuello de la vejiga. Retirando la sonda caudalmente hacia las imágenes del esfínter anal, se observará el ápice prostático y uretra proximal. En algunas sondas biplano, las imágenes transversales se logran inclinando el mango de la sonda a derecha o izquierda usando el esfínter anal como punto de apoyo. Inclinar la sonda hacia el escroto produce más imágenes cefálicas y la inclinación de la sonda hacia el sacro produce imágenes caudales.
También hay dos enfoques para la manipulación de sondas para el plano sagital. Un método es la rotación de la sonda. La rotación en el sentido de las agujas del reloj produce imágenes del lado izquierdo de la próstata y en sentido antihorario produce imágenes del lado derecho. Alternativamente, se pueden obtener imágenes del plano sagital inclinando la sonda hacia arriba o hacia abajo usando el esfínter anal como punto de apoyo. En posición de decúbito lateral izquierdo, inclinando el mango de la sonda hacia abajo (hacia el piso), se evidencian imágenes del lado derecho de la próstata y maniobrando el ángulo del mango de la sonda hacia arriba (hacia el techo), se obtienen imágenes del lado izquierdo. Los urólogos a menudo prefieren inclinar la sonda porque este método es similar a la manipulación de un cistoscopio y es menos incómodo para el paciente
La Sociedad Americana de Urología, en conjunto a la Sociedad de Enfermeras Urológicas, ha publicado directrices sobre el manejo de los equipos utilizados para la biopsia mediante TRUS a las cuales se puede acceder en este enlace.
Imagenología del cáncer de próstata en la ecografía transrectal
En los primeros estudios las lesiones hipoecoicas se consideraban patognomónicas para el cáncer de próstata. Todas las lesiones hipoecoicas dentro de la zona periférica debían incluirse en el material de biopsia. Sin embargo, con el tiempo se demostró que el 39% de todos los cánceres son isoecoicos y hasta un 1% de los tumores pueden ser hiperecoicos en la ecografía transrectal convencional de escala de grises(7).
Un estudio de casi 4000 hombres reveló que el cáncer de próstata se detectó en un 25,5% con una lesión hipoecoica y en 25.4% sin tal lesión, con una distinción por muestra de 9.3% para hipoecoicos y 10.4% para áreas isoecoicas para cáncer(8).
Por el contrario, otro estudio señaló que las muestras de biopsia tomadas de una lesión de próstata tienen casi el doble de probabilidades de mostrar cáncer que cuando no hay lesión visible(9). Llegaron a la conclusión de que la búsqueda y la focalización de las lesiones hipoecoicas en la ecografía transrectal de la próstata sigue siendo importante para diagnóstico de cáncer, pero pueden corresponder a otros procesos patológicos como prostatitis(10), infarto prostático(11) y hasta linfoma. Es necesario realizar una biopsia en lesiones hipoecoicas, pero estas lesiones no son patognomónicas para el cáncer como alguna vez se pensó.
Indicaciones para biopsia de próstata
En general, se estima que una biopsia de próstata inicial lleva una tasa de detección de cáncer de próstata del 30%. La detección temprana del cáncer de próstata mejoró notablemente gracias a los programas de cribado por medio del PSA. Estas iniciativas aumentaron la tasa de enfermedad órgano-confinada y potencialmente curable(12). Pero también las mejoras llevaron como consecuencia no deseada al sobrediagnóstico y el sobretratamiento en muchos hombres con cáncer clínicamente insignificante.
Históricamente, muchos clínicos recomendaban biopsia de próstata una vez que el nivel de PSA en suero de un paciente aumentara por encima 4,0 ng / ml. Datos posteriores de estudios de prevención del cáncer de próstata demostraron que no hay un umbral de PSA seguro que pueda descartar el cáncer de próstata en cualquier rango de edad(13).
Al examinar a hombres cuyo nivel de PSA en suero fue de 4.0 ng / mL o menos, un número significativo fue diagnosticado con cáncer de próstata, con una tasa general de detección de cáncer de próstata del 15% para todos los hombres con un nivel de PSA inferior a 4.0 ng / mL y casi el 15% con un puntaje de Gleason de 7 o más(14).
Consideraciones sobre la salud en general, edad del paciente, antecedentes familiares, opciones terapéuticas, deseos del paciente y otros factores de riesgo deben tenerse en cuenta al recomendar la biopsia de próstata. Además, las preocupaciones están creciendo sobre la morbilidad y mortalidad de la biopsia de próstata(15). Hay una variedad de nomogramas en línea disponibles que pueden ayudar en la toma de decisiones.
Organizaciones como la AUA recomiendan una decisión compartida para hombres de 55 a 69 años, en donde los beneficios pueden ser mayores que los riesgos(16). Fuera de este rango de edad, la AUA recomienda que el cribado basado en PSA como rutina no debería recomendarse basado en la evidencia disponible.
La mayoría de las organizaciones tienen diversos valores de corte del nivel de PSA total para biopsia de próstata y dependen cada vez más de los enfoques de estratificación de riesgos y cambios en el nivel de PSA con el tiempo. Los hombres con alto riesgo de tener el cáncer de próstata son los mayores de 50 años o mayores de 45 años y con antecedentes familiares de cáncer de próstata, hombres con un nivel de PSA superior a 1ng/ml a los 40 años y mayor de 2ng/ml a los 60 años(17).
Estrategias de estratificación de riesgo basadas en el PSA en suero se han recomendado para mejorar el rendimiento del PSA en la detección del cáncer de próstata. Estas incluyen la relación de PSA libre/ total, velocidad de PSA y la densidad del PSA, sin embargo, estas no son uniformemente confiable(17). La Nacional Comprehensive Cancer Network (NCCN) aboga por el uso de algunas de estas estrategias de PSA para la decisión de realizar biopsia prostática transrectal.
Se debe recomendar la biopsia de próstata en las siguientes situaciones: Examen dígito rectal patológico independientemente del nivel de PSA; PSA 4 a 10ng/ml según el riesgo/beneficio del paciente; nivel de PSA 2.5 ng/mL o menor con velocidad de PSA 0.35 ng/mL o mayor por año; Nivel de PSA 4.0 ng/mL o mayor, especialmente si la relación PSA libre/total es 10% o menos. Según lo recomendado por la NCCN, la presencia de los nódulos en el examen rectal digital por lo general debería conducir a la realización de biopsia prostática independientemente de los niveles de PSA. En un estudio reciente, el 14% de los cánceres se diagnosticaron solo con el examen rectal digital(18). Sin embargo, las pautas de la American Cancer Society ahora sugieren que se puede realizar el examen de detección del cáncer de próstata con o sin examen rectal(19).
El uso de nuevas técnicas moleculares como la determinación urinaria de PCA3 para identificar hombres en riesgo de un hallazgo positivo de biopsia está evolucionando. Varios estudios han sugerido que PCA3 proporciona información suplementaria para determinar la necesidad de repetir la biopsia próstata(20). En el mayor estudio de este marcador urinario hasta la fecha, la media de PCA3 fue de 27,2 y 52,5 para los pacientes sin y con cáncer, respectivamente, lo que sugiere que esta es una herramienta útil en la identificación de pacientes con riesgo de cáncer de próstata antes de una biopsia inicial(21).
Contraindicaciones para la biopsia de próstata: Coagulopatía significativa, inmunosupresión severa, prostatitis aguda, condiciones anorrectales dolorosa o estenosis anal, son todas contraindicaciones para la biopsia de próstata.
Preparación de pacientes para biopsia
Se debe informar a los pacientes sobre los riesgos y beneficios del procedimiento y obtener consentimiento informado previo a la realización del procedimiento. Suplementos herbales también deben suspenderse porque muchos contienen agentes no declarados. Las dosis bajas de aspirina no necesitan descontinuarse(22). Terapia anticoagulante (warfarina, clopidogrel, etc.) debe omitirse de 7 a 10 días antes de la biopsia de próstata. Los nuevos anticoagulantes orales como apixabán, dabigatrán y rivaroxabán se deben omitir de 2 a 5 días antes(23). Rivaroxabán puede aumentar el riesgo de accidente cerebrovascular si se detiene; por lo tanto, se recomienda realizar un cambio con algún otro anticoagulante como la heparina. Para esos pacientes con coagulopatía subyacente o con warfarina, la biopsia prostática no debe realizarse hasta que el INR se ha corregido por debajo de 1,5 si el paciente tiene bajo riesgo de un evento tromboembólico.
Debido al mayor riesgo de eventos tromboembólicos (por ejemplo, válvulas mecánicas), se sugiere en pacientes con esquemas de Warfarina cambiarlos a anticoagulación con heparina no fraccionada o de bajo peso molecular.
Es útil una pequeña cantidad de orina en la vejiga antes de la biopsia. Esto ayuda a facilitar el examen al demostrar la unión prostática de la vejiga.
Profilaxis antimicrobiana
Recientemente se ha observado una frecuencia creciente de complicaciones con la mayoría de las hospitalizaciones posteriores a la biopsia a causa de infecciones(24). Esto ha puesto un enfoque renovado en la profilaxis antibiótica y otras estrategias para reducir las complicaciones infecciosas post-biopsia.
A diferencia de otros procedimientos del tracto urinario inferior, se recomienda la profilaxis antimicrobiana para todos los pacientes sometidos a biopsia de próstata, independientemente de los factores de riesgo. El 2014 se actualizó la política de mejores prácticas de la Asociación Americana de Urología, con antibióticos recomendados para la biopsia de próstata entre los que se incluyen fluoroquinolonas, cefalosporinas de tercera generación y aminoglucósidos. La actualización agrega trimetoprim-sulfametoxazol oral como agente profiláctico(25).
En pacientes con riesgo de desarrollar endocarditis, infección de prótesis articulares, o portadores de marcapasos cardíacos, se debe considerar en la profilaxis ampicilina intravenosa (vancomicina, si es alérgico a las penicilinas) y gentamicina preoperatoriamente, seguido de 2 a 3 días de una fluoroquinolona oral.
Enema de limpieza
Rutinariamente, los pacientes se auto administran un enema de limpieza en casa antes de la biopsia. Esta práctica disminuye la cantidad de heces en el recto, produciendo así una ventana acústica superior para la imagen de la próstata. El efecto del enema en la reducción de infecciones es discutible.
Analgesia
La infiltración de anestesia guiada por ultrasonido transrectal cerca de los haces nerviosos puede proporcionar un excelente control del dolor(26, 27). Se logra un bloqueo prostático local usando 1% a 2% de lidocaína, una aguja espinal larga (7 pulgadas, calibre 22) a lo largo del canal de biopsia del transductor y guía ecográfica.
Existen múltiples variaciones para la infiltración de anestésico local para la biopsia transrectal(28). Inyectando 5 ml de lidocaína a nivel de las vesículas seminales cerca de la base de la vejiga en la almohadilla de grasa hiperecoica que demarca la unión de las vesículas seminales y la próstata, se produce un excelente bloqueo bilateralmente. Otros enfoques infiltran 10 ml a partir de la unión de las vesículas seminales e infiltrando a lo largo de la cara lateral de la próstata desde la base hasta el ápice. La infiltración directa en la próstata (inyección intraprostática) puede aumentar el beneficio anestésico visto con la inyección periprostática(29).
Los esquemas de biopsia de saturación pueden requerir hasta 22 ml de lidocaína al 1%. Sin embargo, se requiere precaución para evitar inyección intravascular debido al riesgo de absorción sistémica de lidocaína. La instilación intrarrectal (tópica) de un anestésico local es inferior a la infiltración periprostática(17).
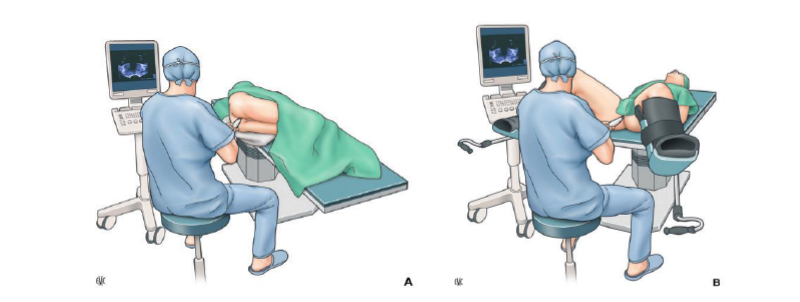
Posicionamiento del paciente
Los pacientes generalmente se colocan en decúbito lateral izquierdo con rodillas y caderas flexionadas en 90 grados. Las nalgas deben estar al ras con el final de la mesa para permitir la manipulación del transductor y la pistola de biopsia sin obstrucción. Si es necesario, el decúbito lateral derecho o la posición de litotomía puede ser usado. La posición de litotomía es utilizada por algunos médicos y se prefiere para biopsias transperineales, tratamiento de braquiterapia planificación o colocación de marcadores fiduciales o para radioterapia con haz externo(30).

Técnicas de biopsia de próstata transrectal
Se debe realizar un examen rectal digital inicial para evaluar cualquier alteración como nódulos prostáticos o procesos patológicos anales. Se determina el volumen de la próstata y se obtienen imágenes de la próstata en los planos transversal y sagital. El examen por lo general comienza en la base de la glándula y se extiende hasta el ápice. Las unidades de ultrasonido más moderna se configuran automáticamente para una visualización óptima de la próstata. Se debe señalar la ubicación y características de cualquier lesión (es decir, hipoecoicas, hiperecoicas, calcificaciones, anormalidades del contorno, estructuras quísticas). La muestra de biopsia por lo general se coloca en formalina al 10%.
Biopsia sextante
El esquema de biopsia sextante original (una muestra desde la base, medio, y ápice bilateral) mejoró significativamente la detección de cáncer sobre biopsia dirigida digitalmente de nódulos palpables(5).
Los estudios de muestras de prostatectomía radical demostraron que la gran mayoría de los adenocarcinomas surgen en la zona periférica posterolateral(31), explicando así algunos de los resultados falsos negativos de la biopsia sextante estándar(32).
Técnicas de biopsia doble sextante o de núcleo extendido
Las modificaciones al esquema estándar de biopsia sextante inicialmente se centraron en la importancia de las muestras dirigidas lateralmente(3). Numerosos estudios han demostrado mejores tasas en la detección del cáncer mediante la incorporación de muestras adicionales dirigidas lateralmente. En la actualidad, seis muestras son consideradas inadecuadas en la biopsia de próstata de rutina para la detección de cáncer.
Hoy, la biopsia sistemática extendida de 12 muestras que incorpora los núcleos apicales y laterales permiten una detección máxima del cáncer y evitan así someter al paciente a una biopsia repetida, minimizando a su vez la detección de cánceres de próstata insignificantes. Este enfoque ha sido respaldado en un reciente documento técnico de la AUA(4, 34).
Aunque aumentando el número de muestras de 6 a 12 resulta en un aumento significativo en la tasa de detección de cáncer, aumentando el número de muestras a 18 o 21 (a menudo denominado biopsia de saturación) como una estrategia de biopsia inicial no parece dar lugar a un incremento similar en el porcentaje de detección. En la actualidad, es más probable que se considere la biopsia de saturación en el contexto de una biopsia negativa previa.
La zona de transición y las vesículas seminales no se muestrean rutinariamente porque estas regiones tienen rendimientos consistentemente bajos para la detección de cáncer en la biopsia inicial(35), pero biopsias dirigidas a la zona de transición pueden ser necesarias para diagnosticar cáncer de próstata en aquellos pacientes con niveles de PSA persistentemente elevados y biopsias previas negativas(36).
Hoy las imágenes por resonancia magnética (IRM) se utilizan a menudo para detectar y guiar biopsias de estos tumores anteriores que pueden escapar de la biopsia prostática ecoguiada estándar(37). La biopsia de vesículas seminales no se realiza rutinariamente a menos que haya una anormalidad palpable. Algunos autores recomiendan biopsia de vesículas seminales cuando el valor de PSA es mayor que 30 o si se está considerando la braquiterapia38.


Biopsia de próstata repetida y por saturación
El dilema de un paciente que ha tenido una o más próstatas negativas, y aún continúa teniendo un valor de PSA elevado o anormal o examen rectal digital de sospecha para cáncer de próstata, es un escenario clínico común. A menudo estos pacientes han sufrido múltiples biopsias a pesar de la disminución de la detección de cáncer bien documentada con cada biopsia sucesiva(39).
Keetch y colaboradores informaron una tasa de biopsia positiva inicial de 34% en 1136 hombres por cáncer de próstata basados en programa de screening por PSA. Las tasas de detección de cáncer luego cayeron al 19%, 8% y 7% en biopsia 2, 3 y 4, respectivamente(40). Estos hallazgos fueron confirmados por resultados de una serie inicial de ERSPC.
Los rendimientos decrecientes junto con la detección mejorada de cáncer por protocolos de núcleo extendido han llevado a algunos investigadores a examinar las técnicas de biopsia por saturación (es decir biopsia con más de 12 muestras) en este difícil subconjunto de pacientes con resultados negativos en biopsias previas.
Al realizar una biopsia repetida, se debe poner atención en el ápice, que puede no estar adecuadamente muestreado. El uso de nuevos ensayos moleculares y genómicos también tendrán un impacto en la toma de decisiones en el futuro en el contexto de una biopsia de próstata negativa(20, 41-43).
El uso de RNM para apoyar este procedimiento y la técnica de biopsia por fusión se desarrollan en los capítulos de imagenología, biopsia por fusión y cáncer de próstata en el Manual.
Riesgos y complicaciones de la biopsia de próstata
Aunque generalmente se considera un procedimiento seguro, la biopsia de la próstata puede estar asociada con complicaciones. La incidencia de las complicaciones graves que requieren hospitalización es relativamente bajas (<1%).
En un estudio canadiense de más de 41,000 hombres con resultados de biopsia negativos, la tasa de ingreso hospitalario de 30 días después de la biopsia a la próstata aumentó de 1.0% en 1996 a 4.1% en 2010(44). La mayoría de los ingresos hospitalarios (72%) estaban relacionados con infecciones bacterianas.
Una descripción general de las complicaciones comunes incluye hematospermia, hematuria, sangrado rectal, prostatitis, fiebre, epididimitis, retención urinaria y otras complicaciones que requieren hospitalización(17). Las grandes series de detección como el PLCO y el ERSPC muestran que la biopsia de próstata no está asociada con un exceso de mortalidad y la tasa general de complicaciones infecciosas es inferior al 1%(45).
Infecciones de post-biopsia
La mayoría de las complicaciones infecciosas después de la biopsia guiada por ecografía transrectal se limitan a infecciones urinarias sintomática y enfermedad febril de bajo grado, que puede ser fácilmente tratado con antibióticos orales o intravenosos. Sin embargo, las hospitalizaciones por complicaciones infecciosas varían de 0.6% a 4.1%, con la incidencia reportada de ITU de 2% y 6%(31,34).
Aunque las hospitalizaciones por la sepsis aumentan después de la biopsia de próstata, los datos sugieren que la mortalidad en este grupo no fue excesiva en comparación con eso de otras infecciones sistémicas similares(45). La sepsis es un síndrome clínico caracterizado por una reacción inflamatoria sistémica producto de un proceso infeccioso. Los síntomas son inespecíficos y pueden incluir fiebre, hipotermia, taquipnea, taquicardia, alteración estado mental e hipotensión(20, 47). Cualquier paciente quien presenta fiebre después de una biopsia de próstata debe ser evaluado por la presencia de sepsis.
Un factor principal para la infección severa parece ser la presencia de bacterias fecales resistentes a fluoroquinolona posiblemente debido al uso de estos agentes ampliamente en entornos de atención médica. El uso de profilaxis dirigida según cultivo de la flora rectal tiene alguna utilidad en comparación con la profilaxis antibiótica empírica en algunas series.
Los organismos que se reportan como resultado de sepsis son predominantemente E. coli, con altas tasas de resistencia a las fluoroquinolonas, trimetoprim-sulfametoxazol y ampicilina. Sin embargo, todos los aislamientos de esta serie eran susceptibles a las cefalosporinas de segunda y tercera generación, amikacina y carbapenems (Ej: Mipenem, meropenem)(46).
Los factores de riesgo para la infección relacionada con la biopsia de próstata incluyen: Raza no blanca, mayor número de comorbilidades, diabetes mellitus, mayor volumen prostático, viajes al extranjero y uso de antibióticos recientes. Otro factor de riesgo fue el número de biopsias previas.
Familiarizarse con los patrones de resistencia local a los antibióticos pueden ayudar en el tratamiento rápido de síntomas infección después de una biopsia de próstata.
Sangrado
Incluso con parámetros de coagulación normales, el sangrado es la complicación más común observada después de una biopsia de próstata. La biopsia de próstata se considera un procedimiento con riesgo intermedio de sangrado(48). Como se señaló, cualquier medicamento potencial que pueda alterar la coagulación deben omitirse durante 5 a 7 días antes de la biopsia o remplazarse según corresponda.
Dos grandes programas de detección europeos observaron hematuria en 23% a 63% de hombres después de una biopsia sextante, con retención aguda de orina por formación de coágulos en 0.7%. El sangrado rectal es común y visto en 2.1% a 21.7% de pacientes(49).
El sangrado rectal es típicamente menor y fácilmente controlado con presión directa por el transductor de ultrasonido o sonda o digitalmente. La pérdida de sangre rápida y persistente por recto pueden requerir una intervención más agresiva para el control. Medidas adicionales incluyen el taponamiento rectal con condón inflado, anoscopía / colonoscopía con inyección de epinefrina o uso de agentes escleroterapéuticos, angiografía con embolización, exploración transrectal y sutura(47).
La hematospermia, comúnmente observada después de una biopsia, es por lo general autolimitada, pero puede causar ansiedad significativa si no se discute en el momento de la biopsia; 9.8% a 50.4% de los hombres experimentan algo de sangre en su eyaculación(49). En un estudio la duración media de la hemospermia fue de 4 (± 1.4) semanas. Ningún factor predijo la duración de la hemospermia(50).
Otras complicaciones
La ansiedad y las molestias excesivas de la sonda endorrectal pueden produce una respuesta vasovagal moderada o severa en 1.4% a 5.3% de pacientes(49,51) y puede requerir la terminación del procedimiento. Colocar al paciente en la posición de Trendelenburg y el uso de hidratación intravenosa generalmente logran resolver estos síntomas. La retención urinaria aguda que requiere cateterismo temporal se desarrolla en 0.2% a 0.4% de pacientes después de la biopsia(49). Cualquier biopsia de próstata puede aumentar el IPSS, pero esto parece ser transitorio.
Los efectos de la biopsia de próstata en la disfunción eréctil han sido caracterizados de manera incompleta. Estudios iniciales sugirieron que la disfunción eréctil después de la biopsia se debió a un daño a los paquetes neurovasculares(52). Desde entonces los estudios han sido conflictivos, con un trabajo más reciente que sugiere que la disfunción eréctil es más pronunciada en hombres que tuvieron un diagnóstico de cáncer de próstata que en aquellos que estaban libres de cáncer(53).
Bibliografía
1. Linden RA, Weiner PR, Gomella LG, Dicker AP, Suh DB, Trabulsi EJ, Valicenti RK. Urology. 2009 Apr;73(4):881-6. doi: 10.1016/j.urology.2008.10.071. Epub 2009 Feb 4. PMID: 19193411.
2. Das S, Liu T, Jani AB, et al. Comparison of image-guided radiotherapy technologies for prostate cancer. Am J Clin Oncol 2014;37:616–23.
3. Strom TJ, Wilder RB, Fernandez DC, Mellon EA, Saini AS, Hunt DC, Pow-Sang JM, Spiess PE, Sexton WJ, Poch MA, Biagioli MC. Radiother Oncol. 2014 Apr;111(1):126-31. doi: 10.1016/j.radonc.2014.02.011. Epub 2014 Apr 17. PMID: 24746567
4. Bjurlin MA, Carter HB, Schellhammer P, et al. Optimization of initial prostate biopsy in clinical practice: sampling, labeling and specimen processing. J Urol 2013;189:2039–46.
5. Hodge KK, McNeal JE, Terris MK, et al. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989;142:71–5.
6. Aubry W, Lieberthal R, Willis A, Bagley G, Willis SM 3rd, Layton A. Budget impact model: epigenetic assay can help avoid unnecessary repeated prostate biopsies and reduce healthcare spending. Am Health Drug Benefits. 2013 Jan;6(1):15-24.
7. Shinohara K, Wheeler TM, Scardino PT. The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations. J Urol. 1989 Jul;142(1):76-82. PMID: 2659828.
8. Onur R, Littrup PJ, Pontes JE, Bianco FJ Jr. Contemporary impact of transrectal ultrasound lesions for prostate cancer detection. J Urol. 2004 Aug;172(2):512-4. PMID: 15247717.
9. Toi A, Neill MG, Lockwood GA, Sweet JM, Tammsalu LA, Fleshner NE. The continuing importance of transrectal ultrasound identification of prostatic lesions. J Urol. 2007 Feb;177(2):516-20. PMID: 17222623.
10. Terris MK, Macy M, Freiha FS. Transrectal ultrasound appearance of prostatic granulomas secondary to bacillus Calmette-Guerin instillation. J Urol. 1997 Jul;158(1):126-7. PMID: 9186337.
11. Purohit RS, Shinohara K, Meng MV, Carroll PR. Imaging clinically localized prostate cancer. Urol Clin North Am. 2003 May;30(2):279-93.
12. Catalona WJ, Smith DS, Ratliff TL, et al. Detection of organ-confined prostate cancer is increased through prostate-specific antigen-based screening. JAMA 1993;270:948–54.
13. Thompson IM, Ankerst DP, Chi C, et al. Operating characteristics of prostatespecific antigen in men with an initial PSA level of 3.0 ng/ml or lower. JAMA 2005; 294:66–70.
14. Thompson IM, Pauler D, Goodman PJ, et al. Prevalence of prostate cancer among men with a prostate-specific antigen level < or = 4.0 ng per milliliter. N Engl J Med 2004;350:2239–46.
15. Zlotta AR, Nam RK. To biopsy or not to biopsy: thou shall think twice. Eur Urol 2012;61:1115–7, discussion 1117–8.
16. Carter HB, Albertsen PC, Barry MJ, et al. Early detection of prostate cancer: AUA guideline. J Urol 2013;190:419–26.
17. Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. I. Screening, diagnosis, and local treatment with curative intent: update 2013. Eur Urol 2014;65:124–37.
18. Okotie OT, Roehl KA, Han M, Loeb S, Gashti SN, Catalona WJ. Characteristics of prostate cancer detected by digital rectal examination only. Urology. 2007 Dec;70(6):1117-20
19. Smith RA, Manassaram-Baptiste D, Brooks D, et al. Cancer screening in the United States, 2014: a review of current American Cancer Society guidelines and current issues in cancer screening. CA Cancer J Clin 2014; 64:30–51.
20. Gittelman MC, Hertzman B, Bailen J, et al. PCA3 molecular urine test as a predictor of repeat prostate biopsy outcome in men with previous negative biopsies: a prospective multicenter clinical study. J Urol 2013;190: 64–9.
21. Chevli KK, Duff M, Walter P, et al. Urinary PCA3 as a predictor of prostate cancer in a cohort of 3,073 men undergoing initial prostate biopsy. J Urol 2014;191:1743–8.
22.- Giannarini G, Mogorovich A, Valent F, et al. Continuing or discontinuing low-dose aspirin before transrectal prostate biopsy: results of a prospective randomized trial. Urology 2007;70:501–5.
23. Culkin DJ, Exaire EJ, Green D, Soloway MS, Gross AJ, Desai MR, White JR, Lightner DJ. Anticoagulation and antiplatelet therapy in urological practice: ICUD/AUA review paper. J Urol. 2014 Oct;192(4):1026-34. doi: 10.1016/j.juro.2014.04.103. Epub 2014 May 21. Review.
24. Loeb S, Vellekoop A, Ahmed HU, et al. Systematic review of complications of prostate biopsy. Eur Urol 2013;64:876–92.
25. American Urological Association. Best practice policy statement on urologic surgery antimicrobial prophylaxis, http://www.auanet.org/content/media/antimicroprop08.pdf>; 2008 (revised August 2011, updated January 1, 2014) [accessed 04.05.14].
26. Berger AP, Frauscher F, Halpern EJ, Spranger R, Steiner H, Bartsch G, Horninger W. Periprostatic administration of local anesthesia during transrectal ultrasound-guided biopsy of the prostate: a randomized, double-blind, placebo-controlled study. Urology. 2003 Mar;61(3):585-8.
27. Trucchi A, De Nunzio C, Mariani S, et al. Local anesthesia reduces pain associated with transrectal prostatic biopsy: a prospective randomized study. Urol Int 2005;74:209–13.
28. Ismail M, Gomella LG. Transrectal prostate biopsy. Urol Clin North Am 2013;40:457–72.
29. Cam K, Sener M, Kayikci A, et al. Combined periprostatic and intraprostatic local anesthesia for prostate biopsy: a double-blind, placebo controlled, randomized trial. J Urol 2008;180:141–4, discussion 144–5.
30. Dehnad H, Nederveen AJ, van der Heide UA, van Moorselaar RJ, Hofman P, Lagendijk JJ. Clinical feasibility study for the use of implanted gold seeds in the prostate as reliable positioning markers during megavoltage irradiation. Radiother Oncol. 2003 Jun;67(3):295-302.
31. McNeal JE, Redwine EA, Freiha FS, Stamey TA. Zonal distribution of prostatic adenocarcinoma. Correlation with histologic pattern and direction of spread. Am J Surg Pathol. 1988 Dec;12(12):897-906.
32. Eskew LA, Bare RL, McCullough DL. Systematic 5 region prostate biopsy is superior to sextant method for diagnosing carcinoma of the prostate. J Urol. 1997 Jan;157(1):199-202; discussion 202-3.
33. Terris MK, McNeal JE, Stamey TA. Detection of clinically significant prostate cancer by transrectal ultrasound-guided systematic biopsies. J Urol. 1992 Sep;148(3):829-32.
34. Bjurlin M, Wysock JS, Taneja S. Optimization of prostate biopsy review of technique and complications. Urol Clin North Am 2014;41:299–313.
35. Epstein JI, Walsh PC, Sauvageot J, et al. Use of repeat sextant and transition zone biopsies for assessing extent of prostate cancer. J Urol 1997;158:1886–90.
36. Mazal PR, Haitel A, Windischberger C, Djavan B, Sedivy R, Moser E, Susani M. Spatial distribution of prostate cancers undetected on initial needle biopsies. Eur Urol. 2001 Jun;39(6):662-8.
37. Volkin D, Turkbey B, Hoang AN, Rais-Bahrami S, Yerram N, Walton-Diaz A, Nix JW, Wood BJ, Choyke PL, Pinto PA. Multiparametric magnetic resonance imaging (MRI) and subsequent MRI/ultrasonography fusion-guided biopsy increase the detection of anteriorly located prostate cancers. BJU Int. 2014 Dec;114(6b):E43-E49. doi: 10.1111/bju.12670. Epub 2014 Oct 18.
38. Gohji K, Morisue K, Kizaki T, Fujii A. Correlation of transrectal ultrasound imaging and the results of systematic biopsy with pathological examination of radical prostatectomy specimens. Br J Urol. 1995 Jun;75(6):758-65.
39. Djavan B, Remzi M, Marberger M. When to biopsy and when to stop biopsying. Urol Clin North Am 2003;30:253–62, viii.
40. Keetch DW, Catalona WJ, Smith DS. Serial prostatic biopsies in men with persistently elevated serum prostate specific antigen values. J Urol 1994; 151:1571–4.
41. Partin AW, Van Neste L, Klein EA, et al. Clinical validation of an epigenetic assay to predict negative histopathological results in repeat prostate biopsies. J Urol 2014;192:1081–7.
42. Gomella L, Liu X, Trabulsi E, et al. Screening for prostate cancer: the current evidence and guidelines controversy. CJU 2011;18:5875–83.
43. Amirian ES, Ittmann MM, Scheurer ME. Associations between arachidonic acid metabolism gene polymorphisms and prostate cancer risk. Prostate. 2011 Sep 15;71(13):1382-9. doi: 10.1002/pros.21354. Epub 2011 Feb.
44. Nam RK, Saskin R, Lee Y, et al. Increasing hospital admission rates for urological complications after transrectal ultrasound guided prostate biopsy. J Urol 2013;189(1 Suppl.):S12–7, discussion S17–8.
45. Loeb S. Antimicrobial prophylaxis for transrectal ultrasound biopsy. American Urology Association Update Series, Lesson 1, Vol. 32, 2013.
45. Pinsky PF, Parnes HL, Andriole G. Mortality and complications after prostate biopsy in the PLCO Screening Trial. BJU Int 2014;113:254–9.
46. American Urological Association/Society for Urological Nurses and Associates. A white paper on the incidence, prevention and treatment of complications related to prostate needle biopsy, <http://www.auanet.org/common/pdf/practices-resources/quality/patient_safety/AUA-SUNAPNBWhitePaper.pdf>; 2012 [accessed 07.05.14].
47. Naspro R, Rossini R, Musumeci G, et al. Antiplatelet therapy in patients with coronary stent undergoing urologic surgery: is it still no man’s land? Eur Urol 2013;64:101–5.
48. Djavan B, Waldert M, Zlotta A, Dobronski P, Seitz C, Remzi M, Borkowski A, Schulman C, Marberger M. Safety and morbidity of first and repeat transrectal ultrasound guided prostate needle biopsies: results of a prospective European prostate cancer detection study. J Urol. 2001 Sep;166(3):856-60. Review
49. Abdelkhalek M, Abdelshafy M, Elhelaly H, et al. Hemospermia after transrectal ultrasound-guided prostatic biopsy: a prospective study. Urol Ann2013;5:30–3.
50. Rodríguez LV, Terris MK. Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol 1998;160(6 Pt 1):2115–20.
51. Zisman A, Leibovici D, Kleinmann J, Siegel YI, Lindner A. The impact of prostate biopsy on patient well-being: a prospective study of pain, anxiety and erectile dysfunction. J Urol. 2001 Feb;165(2):445-54.
52. Helfand BT, Glaser AP, Rimar K, et al. Prostate cancer diagnosis is associated with an increased risk of erectile dysfunction after prostate biopsy. BJU Int 2013;111:38–43.
