Capítulo 21
Trasplante renal
- Dr. David Carvajal S. (1), Dr. Felipe Ibieta T. (2), Dr. Enrique Bley V. (3) 3, Dra. Ximena Roca S. (4)
- (1) Hospital del Salvador- Clínica Dávila – (2) Hospital de Imperial – Clínica Alemana Temuco – (3) Clínica Dávila – (4) Unidad de Nefrología Hospital del Salvador
Introducción
Según el registro anual de trasplantes del ISP, en Chile al año 2019 se han realizado un total de 8406 trasplantes renales (1). Esta historia se inicia en los años 60 con el primer trasplante renal en el Hospital Clínico de la Universidad de Chile. Al poco andar se suma el Hospital del Salvador como el primer hospital público en realizar un trasplante renal (2).
Es así como año a año se suman más centros, tanto públicos como privados, cuyo desarrollo en el campo clínico ha permitido llegar a tasas de 10 donantes por millón de habitantes (dpm) el 2019, aunque seguimos lejos de la tasa de donación de países más desarrollados como España o Portugal quienes tienen tasas de 48,3 y 33,4 dpm, y aún incluso por debajo de algunos de nuestros vecinos latinoamericanos. El mejor ejemplo de ello son los países de la costa atlántica, con tasas en Uruguay, Argentina y Brasil de 12, 13 y 17 dpm respectivamente. (1, 2, 3)
Insuficiencia renal crónica terminal
Las Enfermedades Crónicas No Transmisibles (ECNT) se han transformado en la causa de muerte más importante en nuestra población, la que, como consecuencia de su acelerado envejecimiento y constante exposición a factores de riesgo, muestra cifras cada vez más alarmantes. (4)
En este contexto la Enfermedad Renal Crónica (ERC), definida como un clearence de creatinina < 60 ml/hr sostenido por 3 meses y la ERC terminal (aquella con una filtración glomerular inferior a 15 ml/hr), son una de las consecuencias más temidas y costosas de las ECNT, siendo la Diabetes Mellitus (DM) y la Hipertensión Arterial Crónica (HTA) los factores de riesgo más importantes para desarrollarla, desplazando las causas que hace algunos años ocupaban los primeros lugares como las glomerulopatías, malformaciones de la vía urinaria o enfermedad poliquística, por nombrar las más frecuentes. (4,5)
Estimaciones a nivel mundial establecen que la probabilidad de padecer esta enfermedad en población mayor de 40 años es de 1 en 50.
Al año aproximadamente 450.000 personas inician Terapia de Sustitución Renal (TSR), siendo esto la punta del iceberg, ya que se estima que por cada nuevo paciente que ingresa a diálisis u otro tipo de TSR, 7 no tienen acceso a ella, falleciendo prematuramente por esta causa, siendo una de las 3 causas de muerte con el mayor aumento desde 1990. (4, 6)
En Chile según la encuesta nacional de salud 2017, la prevalencia de un clearence de creatinina menor a 60 ml/hr es de 2,7%, siendo significativamente mayor en la población mayor de 65 años con una estimación de un 17%. siendo la nefropatía diabética la que da cuenta de más del 40% de los casos de ERC, seguida de la idiopática y la nefroesclerosis. En más del 60% de los pacientes se asocia el diagnóstico de HTA. De ahí la importancia fundamental de la prevención de los factores de riesgo cardiovascular, y el rol preponderante de la pesquisa y manejo precoz de estas patologías. (3, 4, 6)
La DM y HTA tienen prevalencias de un 12,3% y 27,6% respectivamente. De esto también se desprende la importancia de los centros de atención primaria en salud (APS), ya que son ellos los encargados de promover estrategias y hábitos de vida saludable en la población. Son los médicos de APS quienes deben detectar, tratar y derivar oportunamente a los pacientes, y así lograr evitar o retrasar la progresión en los casos que sea posible, lo que está demostrado ser la medida más costo-efectiva para prevenir la aparición de ERC (4, 5)
La detección oportuna se basa en el tamizaje adecuado de los pacientes con factores de riesgo, como DM, HTA y antecedentes familiares de ERC. Este se realiza mediante el control de la presión arterial por parte de la población susceptible, y mediante exámenes simples, ampliamente disponibles en APS como son la creatinina, proteinuria y microalbuminuria. Sin embargo, y lamentablemente en la mayoría de las veces, esto se realiza en etapas tardías, cuando la pérdida de masa renal y la alteración de la función del riñón es tal que la TSR es la única alternativa posible para mantener con vida a estos pacientes. (4, 5)
La hemodiálisis es la forma más común de TSR y son cada día más las personas que acceden a ésta. En Chile está garantizado por el estado el acceso a la TSR y en los últimos 25 años han aumentado en cerca de 30 veces los pacientes en diálisis. Al año 2013 existían más de 15.000 pacientes en diálisis, de los cuales actualmente un 10% se encuentra en lista de espera para trasplante renal. (5)


Pese a los beneficios que trae el acceso a la diálisis para estos enfermos, es sabido que no está exenta de complicaciones, lo que junto a la mortalidad de la ERC propiamente tal, determina que la mortalidad global de los pacientes en hemodiálisis puede llegar incluso al 27%, con una expectativa de vida de menos de 50% a 5 años en grupos etarios de 65 a 74 años. Siendo las enfermedades cardiovasculares la principal causa de muerte en los pacientes en hemodiálisis. (Fig 1)
Lo anteriormente expuesto hace que para los 1200 pacientes candidatos a un trasplante en Chile, sea ésta la mejor alternativa posible para la resolución de su patología. (2,4,5,6)
Evaluacion receptor-donante
Evaluación del receptor
No todo paciente que ingresa a TSR es candidato a trasplante. Del total de los pacientes en diálisis, solo un 9% están en espera de un riñón. Esto se debe a que debemos tener especial cuidado en evaluar y optimizar las condiciones médicas con el fin de minimizar riesgos y situaciones que hagan peligrar al paciente y al injerto. (2, 7)
El proceso de evaluación, que al igual que TSR, el trasplante y su manejo posterior se encuentra garantizado en Chile y se inicia una vez el paciente es evaluado por el nefrólogo, y se plantea la TSR. Al mismo tiempo, si el paciente es candidato a trasplante renal, éste debe ser considerado y propuesto como opción. En este momento el especialista debe tener la precaución de indagar en patrones o conductas como el abuso de drogas o alcohol, una mala adherencia al tratamiento y la presencia de patología cardiovascular severa. Estas, de ser identificadas, debieran hacer descartar al trasplante como alternativa. (2,7)
Hecho esto se debiera derivar al paciente a un centro de trasplante correspondiente, donde un equipo multidisciplinario inicia el estudio y es quien decide el ingreso a la lista de espera.
Idealmente debe iniciar este proceso previo al inicio de la diálisis, lo que además de acortar la espera, ha comprobado que mejora los resultados clínicos de nuestros pacientes. De hecho, existe el concepto del “Preemtive Kidney Transplant”, que promueve, en la medida de lo posible, la realización del trasplante antes del ingreso a TSR, conducta que permite obtener mejores resultados a mediano y largo plazo. (8)
Muy importante en esta etapa de ingreso a lista de espera es que el paciente sea informado de todos los riesgos y beneficios del trasplante, dejando registro de la aceptación o rechazo del mismo. Este consentimiento debe renovarse todos los años en el centro de diálisis respectivo. (2,4)
Las indicaciones de trasplante son:
- Todo paciente con VFG bajo 20 ml/hr sin contraindicación medica
- Expectativa de vida: evaluable caso a caso.
- Edad evaluable caso a caso
Las contraindicaciones absolutas son:
- Cáncer Activo
- Infección aguda o crónica no tratada
- Expectativa de vida inferior a 2 años según informe de especialista
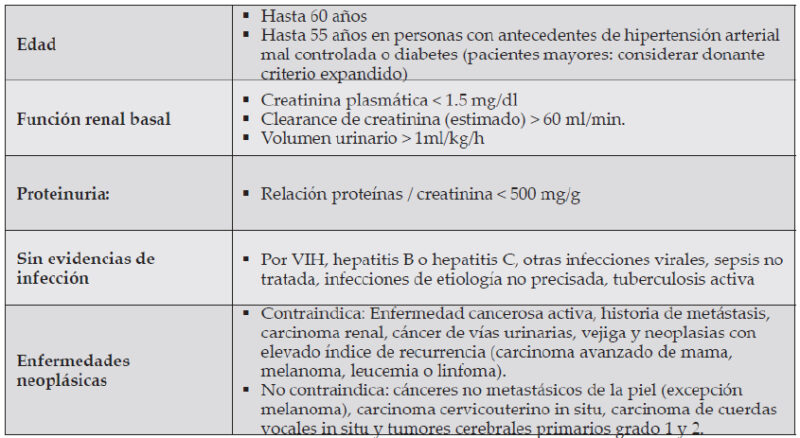
Junto con eso se realiza toda una batería de estudios que van de simples exámenes hasta complejos estudios inmunológicos, virológicos y en algunos casos imagenológicos según sea necesario (2, 7). Fig 2.


Evaluación del donante cadáver
Para que el receptor pueda llegar al pabellón a recibir el tan anhelado órgano, ocurren una serie de procesos estandarizados y estrictamente regulados que se inician con el diagnóstico de muerte cerebral o muerte encefálica (ME), el cual se define como la pérdida total de las funciones del cerebro, incluyendo tronco cerebral. Las causas más frecuentes corresponden a Hemorragias Subaracnoideas Espontáneas (HSA), Traumatismo Encéfalo Craneano grave (TEC).
En nuestro país las normas sobre trasplante y donación de órganos están establecidas en la ley 19.451, definiendo además el estado de ME y su certificación de la siguiente forma: (2, 7)
Artículo 11: Para los efectos previstos en esta ley, la muerte se acreditará mediante certificación unánime e inequívoca, otorgada por un equipo de médicos, uno de cuyos integrantes, al menos, deberá desempeñarse en el campo de la Neurología o Neurocirugía.
Los médicos que otorguen la certificación no podrán formar parte del equipo que vaya a efectuar el trasplante.
La certificación se otorgará cuando se haya comprobado la abolición total e irreversible de todas las funciones encefálicas, lo que se acreditará con la certeza diagnóstica de la causa del mal, según parámetros clínicos corroborados por las pruebas o exámenes calificados. El reglamento deberá considerar, como mínimo, que la persona cuya muerte encefálica se declara, presente las siguientes condiciones:
1. Ningún movimiento voluntario observado durante una hora.
2. Apnea luego de tres minutos de desconexión de ventilador, y
3. Ausencia de reflejos troncoencefálicos.
En estos casos, al certificado de defunción expedido por un médico, se agregará un documento en que se dejará constancia de los antecedentes que permitieron acreditar la muerte.
Artículo 12: Cuando una persona hubiere fallecido en alguno de los casos indicados en el artículo 121 del Código de Procedimiento penal, o cuando su muerte hubiere dado lugar a un proceso penal, será necesaria la autorización del director del Servicio Médico Legal o del médico en quien éste haya delegado esta atribución, para destinar el cadáver a las finalidades previstas en esta ley, además del cumplimiento de los otros requisitos.
En aquellos casos en que el Servicio Médico Legal no tenga la infraestructura material o de personal para otorgar la autorización, o ésta sea necesaria y requerida fuera de su horario normal de funcionamiento, la delegación recaerá en el director de un hospital del Servicio de Salud en cuyo territorio jurisdiccional se produjere la muerte del potencial donante.
El grupo de donante vivo será tocado detalladamente en una sección dedicada a este tipo de pacientes.
Chile no es ajeno al progresivo envejecimiento de la población mundial y la transición demográfica que vivimos, sumado a que la tasa de donación, lamentablemente no ha mostrado el incremento que quisiéramos, nos ha obligado a buscar, o más bien a ampliar los criterios para encontrar donantes renales, de ahí el termino de Donante con Criterio Expandido (DCE), que corresponde a donantes cuyos parámetros clínicos se alejan del ideal (Figura 4), sin embargo actualmente han ayudado a aumentar el pool de donantes. DCE corresponden a pacientes mayores de 60 años, aquellos entre 50 y 59 con comorbilidades o cuya causa de muerte cerebral hacen que sean injertos con un riesgo retardo de función cercano al doble y tasa de filtración glomerular menor en comparación al grupo donante estándar. (2, 7, 9)
Sin embargo, se sabe que para pacientes sobre 65 años o pacientes con prolongada permanencia en TSR y en lista de espera, es mejor someterlos, bajo firma de consentimiento informado, a un trasplante de donante con criterio expandido, ya que la sobrevida de los receptores de estos injertos es mejor y con menos morbilidades que la de los pacientes en TSR. Además, en pacientes que ya no pueden prolongar la espera por un órgano, es una alternativa razonable hasta obtener posteriormente un órgano de un donante estándar.
En el Hospital del Salvador se cuenta con la experiencia más grande en nuestro país en DCE, con resultados promisorios y cifras similares que los donantes con criterio estándar, lo que demuestra que son una buena alternativa para disminuir los tiempos de espera. (2, 7, 9)
Ya definido el concepto médico-legal de la ME podemos continuar en la evaluación de los donantes.



Es labor de los médicos de turno en Unidades de Pacientes Críticos (UPC), detectar potenciales donantes de órganos y contactar a las unidades de trasplante del respectivo centro y así determinar si el paciente se encuentra o no en ME.
Cumplida esta fase, se procede a una completa evaluación de todos los parámetros clínicos del paciente, considerando como primer objetivo determinar si existen o no contraindicaciones absolutas para la donación de órganos, para posteriormente realizar una completa batería de exámenes y estudios (Figura 3 a y b). Autorizada y coordinado el acto de procuramiento, se envían muestras de sangre, ganglios y bazo al ISP para evaluación de crossmatch y HLA, lo que para un donante con criterio expandido no se considera para no prolongar los tiempos de isquemia. (2, 7)


Donante vivo
Es cada vez más laborioso mantener las tasas de donación. Esto, sumado a los mejores resultados y posibilidad de realizar trasplantes precoces, sustentan la realización de trasplantes con donante vivo. (2, 9)
No obstante, los equipos de trasplante deben ser tremendamente criteriosos en la elección de los pacientes y balancear riesgo de dejar a un paciente monorreno versus la probabilidad de éxito del injerto. En este contexto, el trasplante debe llevarse a cabo solo si la probabilidad de éxito supera ampliamente a los riesgos en el donante. (2,9)
En Chile cerca del 25% de los trasplantes son de donante vivo, con una tasa cercana a 4 por millón de habitantes al año, con cerca de 60 casos anuales en promedio, muy lejos de los cerca de 6500 casos anuales de EEUU, con tasa de 21 por millón o Brasil con 10 por millón. Su selección desde el punto de vista inmunológico es muy similar a la tipificación de un donante cadáver. (2, 9, 10)
La mortalidad quirúrgica de la nefrectomía es cercana al 0.02%. Esta cifra es atribuible al perfeccionamiento de la técnica laparoscópica, convirtiéndola en el gold estándar actualmente.
Respecto a la filtración glomerular a corto plazo del donante, estudios modernos y algunos clásicos de los años 50, muestran una rápida adaptación de la masa renal remanente, con VFG inmediatamente post nefrectomía de alrededor de 60%, llegando a cerca del 70% de la VFG original, lo que clínicamente no es relevante para el paciente. Sin embargo, en individuos mayores de 60 años, se estima que en la mayoría pueden caer en ERC con VFG bajo 60ml/hr, siendo similar el riesgo de pérdida significativa de la VFG para pacientes obesos. De ahí la importancia de seleccionar correctamente a los pacientes. (2, 7, 9)
El riesgo de desarrollar proteinuria, se estima cercano al 10% de los pacientes, no estando clara la relación en ellos, entre proteinuria y ERC.(2)
Existen seguimientos a largo plazo (más de 20 años) a pacientes que han sido donantes vivos relacionados, lo que ha permitido elaborar modelos matemáticos sobre incidencia y progresión de ERC, información vital para un buen manejo de esta población.
En lo que al receptor se refiere, el trasplante con donante vivo tiene ventajas sobre el donante cadáver, dada las mejores tasas de sobreviva global del injerto, principalmente por menos tiempo de isquemia, menor probabilidad de rechazo, mejor sobrevida del receptor, dado que como mencionamos previamente, puede acceder al trasplante antes de caer en hemodiálisis, lo que tiene mejor pronóstico que un trasplante en un paciente en diálisis. (2, 7, 10)
En resumen, el trasplante con donante vivo, tiene mejores probabilidades de éxito para el receptor y no ofrece mayores complicaciones o riesgos para el donante, los que se reducen aún más con una adecuada selección del mismo. Aun considerando lo anterior, los riesgos y beneficios deben ser muy bien explicados y conocidos por el paciente.
Preservación del injerto renal
Independiente de la forma del procuramiento, una vez retirados los órganos corresponde el proceso de preservación renal. Esto comienza en el acto operatorio con la perfusión con soluciones para este fin, la que se inicia con la canulación de la aorta y la cava posterior al clampeo pre y post renal, para luego infundir la solución de perfusión, la que tiene como función evitar o disminuir la injuria isquémica y el daño por reperfusión, manteniendo la integridad estructural y funcional del órgano, aumentando así el tiempo para distribuir los órganos entre los distintos centros de trasplantes. (2)
Los mecanismos implicados en el daño celular del injerto son complejos, pero de modo somero podemos decir que esto ocurre secundario a la depleción del ATP con la consiguiente falla de la bomba Na/K y falla de la homeostásis celular, con edema intracelular, activación del metabolismo anaeróbico y acumulación de radicales libres de oxígeno y finalmente la muerte celular. (2, 13)
A lo largo de los años se han ido desarrollando varios tipos de soluciones de perfusión, habiendo varios estudios que intentan comparar unas por sobre otras, con resultados dispares. Entre las más usadas en la actualidad como son por ejemplo la Wisconsin y Celsior (Figura 5).
Independiente de la solución, el fin último es como ya mencionamos, es detener el proceso de daño por isquemia y reperfusión celular, siendo la solución Celsior la usada actualmente por las unidades de trasplante en Chile. Esta proporciona las ventajas de tener un potente buffer (histidina) así como una alta concentración de sodio y baja de potasio, al tiempo que posee una baja viscosidad. (2, 13)
En algunos trabajos que comparan ambas soluciones se encontró que la solución Celsior logra en promedio significativamente menor de creatinina sérica y reducción no significativa de las tasas de NTA. A lo anterior se agrega el beneficio de tener un menor costo. Independiente de la solución a utilizar, es crucial la conservación en frío del órgano a trasplantar, y desde el momento del procuramiento se utiliza hielo estéril en el campo quirúrgico y posteriormente en la unidad de traslado. (2, 7)


Inmunología del trasplante
Desde los albores del siglo XX los médicos e investigadores dedicados al trasplante de órganos entienden que un enemigo común es nuestro sistema inmune, cuya fundamental tarea es vista como el principal escollo en el éxito del trasplante. No es sino hasta los años 50 que gracias a los trabajos de Dausset quien describe al complejo mayor histocompatibilidad (HLA) y de Snell y Gores, quienes descubren que es éste el responsable de desencadenar los fenómenos de rechazo. Gracias a esto, junto a las experiencias acumuladas en EEUU y Europa en trasplantes en gemelos idénticos en los que no se observó rechazo alguno, es que se construyen las bases para el tratamiento inmunosupresor, usado por primera vez a mediados de los 60 en trasplante con donante cadáver. (7)
Luego de esta breve reseña histórica, es fundamental una somera descripción del HLA. Los genes que lo codifican se encuentran en el brazo corto del cromosoma 6, habiéndose identificado unos 400 genes en el MHC humano. Las moléculas HLA son altamente polimórficas y se expresan como heterodímeros en la superficie celular. Este polimorfismo extremo ha permitido conocer al menos 490 alelos.
Respecto a sus características estructurales y funcionales los genes y moléculas HLA principales se separan en clase I y clase II. Los aspectos funcionales están en relación a su capacidad para procesamiento y presentación antígénica. Esta y el posterior reconocimiento del antígeno es un proceso inmunológico de reconocimiento de lo propio y la capacidad para desarrollar una respuesta inmune específica de antígeno hacia los antígenos no propios, actuando como un verdadero código de identidad celular. (2, 7, 14)
Las moléculas HLA de clase I (contiene los loci HLA-A, -B y -C) expresadas en la mayoría de las células somáticas en el hombre, presentan niveles variables de tejido a tejido. La expresión de estas moléculas es influenciada por muchos factores, como citoquinas y linfoquinas. En comparación con clase I, el rango de tejidos que expresan moléculas HLA de clase II (contenedora de los loci HLA-DR, -DQ y -DP) es más limitado, pero, por inducción por citoquinas, el número de tejidos que pueden expresarlas es mayor y están presentes en las células presentadoras de antígeno. (2, 14, 15)
La definición de compatibilidad es el número de antígenos presentes en el donante y receptor, para HLA se evalúan los antígenos A, B, DR y DQ, cada uno en número de 2. Por lo tanto, la máxima compatibilidad se define como 8/8.
Lamentablemente para los equipos de trasplante, aparte de los antígenos mayores de histocompatibilidad, otra barrera inmunológica para el trasplante es el grupo ABO. Además existen otros tipos de antígenos de histocompatibilidad, con especial relevancia en trasplante de médula ósea, siendo estos posibles responsables de un eventual rechazo. (2, 14, 15). Fueron descubiertos en pacientes que cursaban con rechazo en ausencia de anticuerpos antiHLA. Los más estudiados en el trasplante renal son conocidos como Gen A relacionado a la Cadena 1 del HLA o en inglés como Major Histocompatibility Complex class 1 Chain related Gen A (MICA). Estos genes codifican anticuerpos que estarían relacionados con el rechazo crónico en algunos pacientes y constituyen un campo de investigación cuyas aplicaciones a la clínica aún se encuentran en estudio. (2, 14, 15)
La respuesta inmune de los pacientes depende en parte del grado de compatibilidad con el donante y conocerla es muy importante para determinar los mecanismos de rechazo de un injerto, al que nos referiremos más adelante en este capítulo.
El origen de esta respuesta se inicia incluso antes del trasplante. En esto están implicados procesos tanto en el donante como en el receptor, en quien el desarrollo de anticuerpos antiHLA previo al trasplante pueden ocurrir en cualquier momento de la vida, como por ejemplo embarazo, trasplantes previos y transfusiones. También se sabe que desde la injuria isquémica post muerte cerebral, junto con el daño por reperfusión, aumentan la expresión de antígenos del HLA en el injerto, esto a su vez causa la liberación de citoquinas proinflamatorias y activa la cascada de la inflamación en el receptor, aumentando así el riesgo de rechazo. (2, 14, 15)
Con el vasto conocimiento alcanzado en el campo de la inmunología aplicada al trasplante, las cifras de complicaciones secundarias al rechazo son cada día menos frecuentes.
Todo paciente en lista de espera debe tener una tipificación de anti HLA periódica, así al momento del trasplante se toman muestras del donante para evaluar mediante pruebas cruzadas o “crossmatch” su compatibilidad con el receptor, el que de presentar anticuerpos preformados tiene una contraindicación de recibir ese riñón. Para estos fines en Chile se conserva una seroteca en el ISP de los pacientes en lista de espera, y se mantiene una constante actualización de su reactividad ante un panel de linfocitos representativo de la población general (o PRA, anticuerpos reactivos con panel) ya que con esto se realizan las pruebas cruzadas y la determinación de anticuerpos anti HLA. (2, 14, 15)
El procedimiento seguido en Chile consta de las siguientes etapas: A todos los donantes cadáver, a partir de muestras de ganglios y bazo se les realiza determinación de antígenos HLA. La información se ingresa a un software de gestión de Trasplante, el que almacena la información de todos los receptores que están en lista de espera para un trasplante renal. El programa genera un listado priorizado con puntajes en base a criterios preestablecidos por ley.
A los receptores con mayor puntaje se les realizan las pruebas de reactividad cruzada o Crossmatch. Aquellos cuyo resultado sea negativo pasan a una lista final respetando el puntaje previo. Esta prueba se realiza con el fin de evitar la pérdida inmediata del injerto y para detectar en el suero de los receptores anticuerpos preformados dirigidos contra los antígenos HLA presentes en las células de su potencial donante. El resultado positivo de esta prueba es una contraindicación para realizar el trasplante.
Se informa de esta selección al coordinador de turno de la Coordinación Nacional de Trasplante del Ministerio de Salud, quien ofertara, de acuerdo a la priorización entregada, a los diferentes centros de trasplante donde pertenecen los receptores seleccionados. El laboratorio posteriormente verifica que la distribución de los órganos se realice de acuerdo a la selección entregada.
Para trasplante con donante vivo se realiza esta prueba entre 2 semanas y 3 días antes del trasplante y ante un evento que el equipo médico considere sensibilizante posterior al crossmatch, debiera realizar una nueva prueba dos semanas después al evento, postergando el trasplante. (2)
Ahora podemos comprender lo complejo que es el proceso de selección de los receptores, y todo lo que hay detrás del acto quirúrgico, que un eslabón o el fin de la larga cadena que tiene como objetivo lograr el éxito del mismo.
Fármacos inmunosupresores
Si bien no nos corresponde extendernos en este tipo de fármacos debemos mencionar los más frecuentemente usados en nuestro país.
Esteroides (prednisona, metilprednisilona): Actúan inhibiendo la IL-1, IL-6, y TNF, por nombrar algunos de los complejos mecanismos involucrados.
Antiproliferativos (Azatioprina, Micofenolato mofetil y sódico): Fármacos utilizados desde los inicios de los trasplantes junto a los corticoides y que actúa inhibiendo la síntesis de purinas, por ende, la proliferación de linfocitos.
Inhibidores de la Calcineurina (Ciclosporina o Tracolimus): La calcineurina participa en el control de la transcripción de RNA para la síntesis de citoquinas (IL-2, IFN-g, IL-4 y a-TNF). Así inhibe la proliferación de células T evitando la expansión clonal de las células T helper y citotóxicas. Los linfocitos T supresores no se ven afectados.
Anticuerpos policlonales (timoglobulina): Su uso está indicado en el tratamiento del rechazo agudo o rechazo corticoresistente. Su acción es antilinfocitaria y de ahí su uso en las situaciones mencionadas.
Inhibidores de la mTOR (Sirolimus y Everolimus): Actúan a nivel de la proteína mTOR, que participa a nivel de señales intracelulares de codificación de ARN, junto con eso estos fármacos favorecen una redistribución de los linfocitos T y B, los cuales disminuyen en sangre periférica y se acumulan en los nódulos linfáticos y en las placas de Peyer. (16)
Complicaciones
Con el paso del tiempo el trasplante renal se ha convertido en un procedimiento quirúrgico relativamente frecuente, con miles año tras año a nivel mundial. Sin embargo, las complicaciones tanto quirúrgicas y médicas, debemos conocerlas y siempre tenerlas presentes en la evaluación de estos pacientes, y así poder detectarlas y tratarlas precozmente. (7, 17, 18)
Al referirnos al trasplante propiamente tal la técnica quirúrgica está bastante estandarizada y se ha logrado una tasa de éxito bastante alta, con tasas de complicaciones asociadas a la cirugía cada vez menores. Y al compararlas con otros trasplantes como por ejemplo el de hígado son significativamente menores. Pese a esto la demora en el diagnostico o la gravedad de la complicación trae consigo importantes consecuencias para el receptor, como son riesgo de pérdida del injerto e incluso mortalidad asociada.
No es propósito de este texto exponer la técnica quirúrgica del trasplante renal, sin embargo, un conocimiento básico de ésta permite comprender mejor algunas de las complicaciones más frecuentes. (7, 17, 18)
Poco ha variado la técnica original descrita por Kuss en 1951, partiendo con una incisión de Gibson (figura 7a), accediendo por vía extraperitoneal idealmente a la fosa iliaca derecha, luego corresponde la disección de los vasos iliacos externos los que deben ser cuidadosamente liberados del tejido linfático para así evitar una complicación tardía como es el linfocele.
La anastomosis, tanto para la vena como la arteria, más frecuentemente usada es de tipo termino lateral. Luego, una vez comprobada la indemnidad de la anatomizas vascular y la correcta perfusión de injerto, se procede a la inserción del uréter en la vejiga. Para esto existen dos técnicas, la de Leadbetter-Politano o la de Lich-Gregoir, sin mayores diferencias en resultados entre una y otra, pero con conceptos comunes como son la sutura libre de tensión y el trayecto submucoso para evitar el reflujo durante el vaciamiento de la vejiga. (16, 17, 18)
Complicaciones agudas
Retraso en la función inicial del injerto: El riñón, sobre todo el de un donante fallecido, sufre múltiples injurias antes de ser implantado, determinando daño por isquiemia-reperfusión, y un riesgo significativo de necrosis tubular aguda y de retraso en la función del injerto. Entre el 10 y el 50% de los injertos provenientes de DC no tiene función inicial, mientras que en los de DV este riesgo es menor al 1%. Los principales factores de riesgo son: paro cardíaco en el donante, hipotensión prolongada en el donante, tiempo de isquemia fría y caliente prolongados, etc. Se manifiesta por anuria y/o falta de descenso de la creatinina sérica después del trasplante. Debe diferenciarse de las otras complicaciones agudas (trombosis, estenosis del uréter). La ecografía Doppler y la cintigrafía renal dinámica son fundamentales para descartar estas complicaciones. El tratamiento es expectante debiendo mantener un adecuada perfusión y apoyo dialítico. En general, la función se recupera en un plazo de días a semanas. Sin embargo, hasta el 2% de los injertos nunca recuperan función (disfunción primaria del injerto). (7)
Hemorragia: Es la más temida de las complicaciones agudas. Su diagnóstico es clínico, se manifiesta por la visualización directa del sangrado en un drenaje, pero más frecuente con la aparición de taquicardia, hipotensión o dolor del área operatoria, junto a una caída del hematocrito debe hacer de inmediato sospechar en una complicación de este tipo, usualmente ocurre por vasos sanguíneos no ligados en el pedículo del injerto, también pequeños vasos del retroperitoneo o a nivel de la incisión pueden ocasionar un sangrado, que , la mayoría de las veces no requiere exploración quirúrgica, sin embargo, en caso de compromiso hemodinámico severo, requerimiento de transfusiones o compresión del riñón por un hematoma es indicación de exploración quirúrgica de urgencia. (7, 18, 19)
Trombosis: Otra temida complicación es la trombosis de alguno de los vasos del injerto, ocurre en menos del 1% de los casos y tiene consecuencias devastadoras, ya que la mayoría de las veces termina en la pérdida del injerto. En el caso de la trombosis arterial las causas más frecuentes son la torsión de los vasos, disección de la íntima no percibida o arterias múltiples, pueden originarse en problemas técnicos de la cirugía o factores inherentes al paciente y su injerto como por ejemplo ateroesclerosis. Clínicamente se manifiesta con súbita aparición de anuria, la cual, una vez descartada una obstrucción de la vía urinaria, debe ser el primer diagnóstico diferencial a descartar, posteriormente se debe realizar una ecografia doppler renal para confirmar el diagnóstico, la exploración quirúrgica es de regla y casi todos los casos terminaran en nefrectomía por la muy baja tolerancia a la isquemia del riñón trasplantado.
La trombosis de la vena renal, al igual que la arterial, es una grave complicación que compromete directamente la viabilidad del injerto, el diagnóstico es clínico y debe sospecharse ante la aparición de hematuria y dolor con aumento de volumen en la zona del injerto dentro de los primeros 10 días post trasplante. El origen de la trombosis de vena renal está en la compresión por linfocele, torsión o “kinking” del vaso y una sutura con estenosis de la vena. Ante la sospecha doppler renal es de regla y una vez confirmada la trombosis venosa, el paso siguiente es la exploración quirúrgica, cuyo resultado casi el 100% de los casos es la nefrectomía. (7, 19)
Aneurismas y fístulas: Otra complicación vascular potencialmente compleja es la aparición de aneurismas y fístulas arterio-venosas, estas ocurren generalmente secundario a disrupción a nivel de la sutura vascular, infecciones o secundario a biopsias renales. Los aneurismas generalmente son asintomáticos, encontrados como hallazgos en el estudio rutinario del riñón y su manejo la mayoría de las veces es solo observación, pero ante cualquier síntoma como dolor, hematuria, anuria o compromiso hemodinámico debe sospecharse una ruptura. La técnica de reparación depende de la presencia o no de infección y es mediante parche venoso o en el peor de los casos la nefrectomía. Para el caso de las fístulas arterio-venosas la clínica es la hematuria, que de ser masiva puede requerir embolización, de lo contrario y la mayoría de los casos, se resuelven en forma espontánea. (2, 7, 18)
Complicaciones urinarias: De las complicaciones precoces a nivel de la vía urinaria, tenemos la filtración de la anastomosis uretero-vesical y la fistula urinaria. La frecuencia de ambas no supera el 5%. Ocurren secundarias a infección o suturas que producen la isquemia del uréter. Suelen presentarse con fiebre y débito aumentado por el drenaje o la herida (2, 19). El tratamiento pasa por derivación de la orina con una sonda y manejo quirúrgico de la filtración en caso de que lo requiera como por ejemplo reimplante del uréter. (19)
Complicaciones tardías
Fístulas arterio-venosas, aneurismas, pseudoaneurismas y fístulas urinarias: Dentro de las complicaciones tardías del trasplante renal, también debemos contar algunas que pueden aparecer en etapas precoces, como son las fistulas arterio-venosas, aneurismas o pseudoaneurismas del riñón y fistulas urinarias. Haciendo la salvedad que las fistulas A-V en etapa tardía en la gran mayoría de los casos son secundarias a una biopsia renal y el manejo por vía angiografía es la elección. Se deben sospechar siempre ante la aparición de hematuria persistente posterior a una biopsia. (7,18)
Hernia Incisional: Son consideradas complicaciones tardías. Los factores de riesgo para esta complicación, son los mismos que para otras cirugías, sin embargo acá debemos considerar que el uso de corticoides junto con otros inmunosupresores aumentan el riesgo de aparición. La reparación se realiza igual que cualquier hernia incisional, sin embargo, hay que tener en consideración que es prioritario mantener la función del injerto. Una vez estabilizada ésta, estando el paciente con dosis bajas de corticoides podría plantearse la reparación de la hernia. (7,18)
Obstrucción de la vía urinaria: puede ocurrir de manera precoz o tardía, siendo más frecuente la segunda. El origen radica en isquemia de algún segmento de uréter o suturas con demasiada tensión a nivel del neoimplante. Se pesquisa por aumento progresivo de la creatinina, que al estudiar con imágenes, principalmente ecografía, revela una hidroureteronefrosis con calibre normal de la vía urinaria distal a la obstrucción. Si ésta es a nivel del implante ureterovesical la dilatación es completa. El estudio va dirigido a determinar el nivel anatómico de la obstrucción y su repercusión real en el injerto. El examen de elección es un cintigrama MAG3, que inyecta un marcador que se filtra y excreta, por lo tanto permite evaluar la función de filtración y excreción del injerto y así detectar si realmente existe una obstrucción con repercusión en la función del riñón.
El manejo de esta complicación puede ser por vía endoscópica o abierta. Consiste en reimplantar el uréter en obstrucciones distales o incluso se puede utilizar el uréter nativo para la reparación cuando existen obstrucciones proximales que impiden el reimplante de uréter trasplantado. (7,18, 19)
Complicaciones Vasculares: A nivel vascular no desaparecen los riesgos de complicaciones inmediatamente luego de terminado el ingerto, dado que es en el periodo tardío que la estenosis de la arteria renal se reporta hasta en un 10% de los casos. Los factores de riesgo incluyen ateroesclerosis del donante y del receptor, mala técnica de sutura y trauma de la arteria del donante. El sitio de estenosis es la anastomosis en la mayoría de los casos. Se manifiesta por hipertensión refractaria, disfunción del injerto y edema. El doppler de vasos renales es, en manos entrenadas una excelente herramienta diagnóstica con sensibilidad y especificidad de un 87 y 100% respectivamente. El manejo idealmente debe realizarse por vía endovascular, con angioplastía o stent, sin embargo, hay lesiones que no son susceptibles a ser tratadas por esta vía, o que recurren posterior a la vía endovascular y que deben repararse por vía quirúrgica abierta. Se obtienen buenas tasas de éxito para ambos procedimientos, pese a esto el riesgo de pérdida del injerto puede llegar hasta un 10%. (7,18)
Linfocele: Esta es una complicación frecuente que se describen hasta en un 20% de los casos. Se define como una colección de linfa, que se origina en la apertura no percibida o no ligada de vasos linfáticos iliacos. En general es asintomático y no repercute en el injerto, resolviéndose espontáneamente. No obstante, es potencialmente una amenaza para el paciente dado que puede producir compresión de la vía urinaria con alza de la creatinina, o lo que es más frecuente infectarse. En estos casos el manejo es quirúrgico, idealmente el abordaje laparoscópico es de elección, drenando la colección y dejando una ventana abierta hacia el peritoneo. (7,18)
Además de las complicaciones quirúrgicas existen complicaciones médicas dentro de las cuales nos parece importante mencionar la Necrosis Tubular Aguda o NTA, causa muy importante y frecuente de disfunción precoz del injerto. Corresponde a un daño por isquemia y reperfusión. Con terapia de soporte, seguimiento con imágenes, hemodiálisis y limitar el uso de nefrotóxicos, su resolución ocurre los primeros 7 a 14 días. (2, 7)
Rechazo del injerto
La ciencia del trasplante ha avanzado considerablemente durante el último siglo, esto en gran parte gracias al conocimiento adquirido respecto al rol del sistema inmune en el rechazo del órgano y al éxito de la investigación destinada a conocer los mecanismos del rechazo y de la inmunosupresión.
En los años 60 la inmunosupresión ya se conocía y se basaba en el uso de corticoides y drogas como la azatioprina, sin embargo no impedía el temido rechazo agudo. Recién en la década del 80, con el advenimiento de mejores exámenes para evaluar la compatibilidad del donante y el receptor, junto con nuevas drogas como la ciclosporina es que esta entidad clínica fue en franco descenso, y es así como el riesgo de rechazo agudo al año del trasplante bajo a menos de un 15%.
Los tipos de rechazo se clasifican según mecanismo y momento de ocurrencia. (20, 21, 22)
Rechazo Hiperagudo: Es el de peor pronóstico, sin tratamiento conocido más que la trasplantectomía. Ocurre como consecuencia a anticuerpos preformados y se evita con las pruebas cruzadas previas. Se manifiesta prácticamente de inmediato, incluso en el pabellón una vez desclampeadas las anastomosis vasculares, observándose un riñón cianótico y blando o a tensión. (21)
Rechazo Agudo: Existen 2 tipos: Mediado por células y Mediado por Anticuerpos.
El primero esta comandado por la inmunidad innata en primera instancia que actúa ante la injuria por isquemia y reperfusión, lo que favorece el reconocimiento de los antígenos del HLA por parte de los linfocitos T del receptor en las células presentadoras de antígeno. Este rechazo, se caracteriza por una alteración brusca de la función del injerto o la presencia retraso de la función del injerto. Puede ocurrir entre 5 días a 3 meses posterior al trasplante, aunque se han descrito más tardíos.
El segundo tipo o mediado por anticuerpos, también se manifiesta en los primeros días o meses y se produce por sensibilización previa por transfusiones o trasplantes previos. En este caso, además del sistema HLA, entran a jugar un rol otros antígenos menores como los anteriormente mencionados MICA.
Existen factores de riesgo comunes para su aparición y son niveles bajos de inmunosupresión, pacientes hiperinmunizados, retrasplantes, receptores jóvenes y/o de raza negra e incompatibilidad HLA. También existe mayor incidencia en presencia de NTA y de infección por Citomegalovirus, esto por una mayor expresión de antígenos HLA. (21)
Rechazo Crónico: El rechazo crónico es mediado por anticuerpos y ocurre por una agresión por parte del sistema inmune constate o repetidos episodios de rechazo agudo. Es más frecuente ante incompatibilidad HLA y desarrollo a lo largo del tiempo de anticuerpos anti HLA. Se sospecha en pacientes con deterioro de la función del riñón, asociado a hipertensión y proteinuria, y en la mayoría de los casos obedece a conductas de mala adherencia a terapia. (20, 21, 22)
Bibliografía
- www.yodonovida.cl
- Trasplante Renal, Guías Clínicas Sociedad Chilena del Trasplante, 2019
- Newsletter on Trasplant B. Dominguez-Gil. Quality of Medicine & Health Careof the Council of Europe. 2019.
- Prevalencia de enfermedad renal crónica. Carlos Zúñiga. Rev Med Chile vol 139, 9 2011
- XXXVIII Cuenta de hemodiálisis crónica en Chile, H Poblete, Sociedad Chilena de nefrología, 2018
- Epidemiology, contributors to, and clinical trials of mortality risk in chronic kidney failure. A. Ortiz. Lancet 383. 2014
- Nefrología al día, Revista Española de Nefrología. Vol 1. N 1.2019
- Comparison of preemptive kidney transplant recipients with nonpreemptive kidney recipients in single center: 5 years of follow-up. Burak S. Int J Nephrol Renovasc Dis. 6: 95–99. 2013
- Long-term outcomes of kidney transplantation from expanded criteria deceased donors at a single center: comparison with standard criteria deceased donors. Transplant Proc. 2014; 46 (2):431-6.
- Evaluation and Selection of potential live Kidney. W Ehab. J of Urol. Vol 171. 2004
- Global trends in the rates of living kidney donation. L. Horvat. Kidney International (2009) 75, 1088–1098
- Outcome of the living kidney donor. P Delanaye Nephrol Dial Transplant (2012) 27: 41–50
- Preservación de órganos. J Escalante Cobo. Med Intes. Ene 2009
- Major histocompatibility complex class I–related chain A allele mismatching, antibodies, and rejection in renal transplantation. T Steven. Human Immunology. Volume 72, Issue 10, October 2011, Pages 827–834
- Role of MICA antibodies in solid organ transplantation. L Luo. Clin Transplant. 2014 Feb; 28 (2):152-60.
- Operative Urology at the Cleveland Clinic 2006
- Li Li, Amery Chen, Abanti Chaudhuri, Neeraja Kambham, Tara Sigdel, Rong Chen, and Minnie M. Sarwal, Compartmental Localization and Clinical Relevance of MICA Antibodies after Renal Transplantation Transplantation. Feb 15, 2010; 89(3): 312.
- Surgical Complications After Kidney Transplantation Seminars in Dialysis. H Abhinav Volume 18, Issue 6, pages 505–510, November 2005
- Comparative urologic complications of ureteroneocystostomy in kidney transplantation: transvesical Leadbetter-Politano versus extravesical Lich-Gregoir technique. C Baston. Transplant Proc. 2014 Jan-Feb; 46 (1):176-9.
- . Rejection and function and chronic allograft dysfunction. JW Fijter. Kidney Int 2010; 78 (Suppl 119): S38–S41.
- Rejection of the Kidney Allograft.J Brian. N Engl J Med 2010; 363:1451-62.
- Chronic Transplant Rejection. M Hassanein. StatPearl NCBI Bookshelf. Nov 2019
