Capítulo 1 7
Infertilidad masculina
- Dr. Cristian Palma C. (1), Dr. Marcelo Marconi T. (2)
- (1) Clínica Las Condes – Hospital José Joaquín Aguirre – Universidad de Chile – (2) Departamento de Urología – Pontificia Universidad Católica de Chile
Resumen
El factor masculino juega un rol en aproximadamente la mitad de las parejas que consultan por infertilidad. Múltiples patologías pre-testiculares, testiculares y post-testiculares pueden influir en el potencial fértil masculino. Un enfoque diagnóstico adecuado, permitirá identificar una causa específica en la mayoría de los casos. De esta forma se podrá ofrecer el tratamiento que otorga la mayor probabilidad de éxito. Diversas parejas con factor masculino severo, que en el pasado habrían tenido que utilizar semen de donante o considerar la adopción, han podido tener descendencia mediante la recuperación espermática a través de diferentes técnicas, asociada a inyección intracitoplasmática de espermatozoides. Sin embargo, existen situaciones en las cuales será imposible recuperar gametos viables y/o se transmitirán alteraciones genéticas a la descendencia. Una adecuada discusión entre el especialista y la pareja es esencial para decidir la mejor conducta en cada caso.
Introducción
Infertilidad se define como la incapacidad de lograr un embarazo espontáneo después de un año de relaciones sexuales sin la utilización de métodos anticonceptivos. Aproximadamente 15% de las parejas consultan por esta causa (1). El factor masculino es el único responsable en el 20% de los casos, y contribuye a la infertilidad de pareja en el 50% de las ocasiones (2). La prevalencia de infertilidad se calcula en una de cada 5 parejas en países desarrollados y una de cada siete en países en vías de desarrollo. Cuando se está frente a un factor masculino, casi siempre se observará una alteración cuantitativa o cualitativa de uno o más parámetros seminales.
La infertilidad masculina puede ser provocada por una variedad de condiciones. Algunas de ellas se pueden identificar y tratar, como el hipogonadismo hipogonadatrófo; otras se logran diagnosticar, pero no cuentan con un tratamiento específico, como alteraciones genéticas o atrofia testicular. En el 30-40% de los pacientes con alteraciones del espermiograma, el examen físico y las pruebas de laboratorio no logran objetivar una causa específica de la infertilidad, clasificando a estos pacientes como portadores de una infertilidad masculina idiopática (1). Las diferentes técnicas de recuperación espermática, que extraen gametos de diferentes regiones del sistema reproductor masculino, han logrado que parejas con factor masculino severo sin tratamiento específico puedan lograr embarazos y descendencia.
El objetivo de esta revisión es presentar la evidencia actual en relación al estudio del hombre infértil y el manejo específico de las causas más importantes que condicionan dicha infertilidad.
El realizar un estudio completo de estos pacientes, permitirá al especialista (3):
- Tratar las alteraciones corregibles
- Identificar las condiciones sin tratamiento específico, para ofrecer técnicas de reproducción asistida utilizando espermatozoides del paciente
- Identificar las condiciones donde será imposible recuperar gametos masculinos viables, pudiendo ofrecer técnicas de reproducción asistida con semen de donante o adopción
- Reconocer las enfermedades graves que pueden estar manifestándose como infertilidad
- Diagnosticar alteraciones genéticas que puedan afectar la salud o potencial reproductivo de la descendencia
Evaluación del hombre infértil
Se debe realizar una evaluación del factor masculino cuando no se logra embarazo después de un año de relaciones sexuales sin protección. Dicha evaluación se debe realizar antes de un año si existen factores de riesgo para infertilidad masculina (ej. criptorquidia bilateral) o femenina (ej. edad mayor a 35 años) dentro de la pareja (3). La edad femenina es la variable más importante para lograr éxito en reproducción asistida (1,4). Los otros factores pronósticos son la duración de la infertilidad, si es primaria o secundaria, los tipos de alteraciones del espermiograma y el estatus de fertilidad del factor femenino (1).
| Causas pre-testiculares |
| Hipogonadismo hipogonadotrófo congénito |
| Patología hipofisiaria: tumores, enfermedades infiltrativas e infartos |
| Patología suprarrenal: tumores e hiperplasia suprarrenal congenita |
| Infecciones sistémicas, incluyendo enfermedades virales y tuberculosis |
| Neoplasias sistémicas |
| Abuso de esteroides anabólicos |
| Causas testiculares |
| Varicocele |
| Síndrome de Klinefelter |
| Microdeleciones del cromosoma Y |
| Tumores de células germinales |
| Tumores de células de Leydig o de células de Sertoli |
| Falla testicular idiopática |
| Daño vascular o traumático |
| Orquitis previa |
| Exposición a gonadotoxinas: quimioterapia, radiación, fármacos, calor |
| Causas post-testiculares |
| Obstrucción epididimaria congénita, iatrogénica o postinflamatoria |
| Obstrucción de conductos deferentes congénita, iatrogénica o postinflamatoria |
| Obstrucción de conductos eyaculadores |
| Disfunción sexual o eyaculatoria |
Tabla 1. Diagnóstico diferencial de la infertilidad masculina
Modificado de Stahl P, Stember D, Goldstein M. Annu Rev Med 2012; 63:525-540
Existen múltiples causas de infertilidad masculina, las que se presentan en la tabla 1-2. Pueden ser congénitas o adquiridas. Secundarias a patología pre-testicular (eje hipotálamo-hipófisis-gónadas), testicular o post-testicular (desde testículo hasta conductos eyaculadores) (5). Se asume que la infertilidad idiopática está causada por múltiples factores, como alteraciones endocrinas, estrés oxidativo, alteraciones genéticas y epigenéticas (1).
| Etiología | Porcentaje |
| Idiopática | 35% |
| Varicocele | 18% |
| Antecedente de Criptorquidia | 15% |
| Infección de Glándulas Accesorias Masculinas | 8% |
| Drogas / Tóxicos | 8% |
| Genética | 6% |
| Endocrina | 5% |
| Otras | 5% |
Tabla 2. Porcentajes de la etiología de la Infertilidad
La evaluación básica del paciente que consulta por infertilidad incluye (3,5):
- Anamnesis médica y sexual.
- Examen físico.
- Dos espermiogramas.
En relación a los resultados encontrados en la evaluación básica, se podrá solicitar un estudio más avanzado, que puede incluir (3,5):
- Perfil endocrinológico.
- Ecodoppler testicular.
- Ecografía transrectal.
- Cultivo de semen.
- PCR en orina de primer chorro para Chlamydia Trachomatis, Neisseria Gonorrhoeae, Ureaplasma Urealyticum, Mycoplasma Hominis.
- Análisis de orina post-eyaculación.
- Evaluación genética.
- Otras pruebas especializadas
Anamnesis
La anamnesis tiene como objetivo identificar factores de riesgo o hábitos de comportamiento que pueden tener una repercusión sobre la fertilidad del paciente. Se debe investigar acerca de enfermedades previas o actuales, con énfasis en el sistema reproductor (criptorquidia, infecciones de transmisión sexual, etc.) y respiratorio (infecciones respiratorias a repetición pueden estar reflejando fibrosis quística). Se debe preguntar acerca de cirugías previas, con especial énfasis en cirugía inguinal, retroperitoneal o genital (5).
Se debe conocer la historia reproductiva previa de los integrantes de la pareja y los hábitos sexuales actuales (frecuencia de relaciones sexuales y utilización de lubricantes). Alteraciones de la libido, disfunción eréctil y alteraciones de la eyaculación deben ser identificadas. Se deben revisar los fármacos y drogas utilizadas en el presente y pasado. Por último, se debe conocer acerca de exposiciones ambientales a tóxicos que puedan afectar la fertilidad del paciente (3,5).
Examen físico
Se debe iniciar el examen físico con la inspección general del paciente, buscando alteraciones del hábito corporal, alteraciones de los caracteres sexuales secundarios, presencia de ginecomastia y/o cicatrices de cirugías previas. Se debe examinar el pene, incluyendo la posición del meato urinario y estigmas de infecciones de transmisión sexual. Se deben palpar los testículos, evaluando tamaño, consistencia o presencia de zonas induradas. Los epidídimos deben ser identificados, evaluando la presencia de dilatación, induración o dolor a la palpación (5).
Se deben identificar ambos conductos deferentes. La ausencia de ambos conductos puede estar en el contexto de agenesia congénita bilateral de conductos deferentes (CBAVD), manifestándose como azoospermia obstructiva. La ausencia de sólo uno de ellos puede reflejar alteraciones embrionarias del conducto mesonéfrico, lo que se asocia a agenesia renal ipsilateral. El examen debe finalizar con un tacto rectal, aprovechando de evaluar la indemnidad de los reflejos espinales a nivel sacro (3,5).
Análisis seminal
El análisis de los parámetros seminales es la piedra angular de la evaluación andrológica del hombre que consulta por infertilidad. La metodología para procesar y analizar muestras de semen humano ha sido publicada por la Organización Mundial de la Salud (OMS) (6). Las muestras pueden ser recolectadas en el hogar o en el laboratorio, debiendo ser mantenidas a temperatura ambiente y analizadas dentro de una hora. El paciente debe haber mantenido abstinencia sexual por 3 a 5 días (3).
Los valores de normalidad y anormalidad de los diferentes parámetros medidos en el espermiograma han cambiado durante los años. Los valores de referencia actuales son los publicados por la OMS en 2010, derivados de un estudio poblacional internacional de hombres fértiles (1). Los valores anormales se definieron como los que se encuentran bajo el percentil 5, y se presentan en la tabla 3.
| Parámetro | Valor en p5 |
| Volumen seminal | 1.5 mL |
| Número de total de espermatozoides | 39 millones / eyaculado |
| Concentración de espermatozoides | 15 millones / mL |
| Movilidad total (progresiva+no progresiva) | 40 % |
| Movilidad progresiva | 32 % |
| Vitalidad (espermatozoides vivos) | 58% |
| Morfología (formas normales) | 4 % |
| pH | > 7.2 |
| Leucocitos | < 1 millón / mL |
Tabla 3. Criterios de anormalidad de parámetros seminales (percentil 5) OMS 2010
Modificado de Jungwirth A, Giwercman A, Tournaye H, et al.
European Association of Urology guidelines on Male Infertility: the 2012 update. Eur Urol 2012; 62:324-32
Un volumen seminal bajo 1.5 ml puede ser el resultado de recolección incompleta de la muestra, baja testosterona, eyaculación retrógrada u obstrucción de los conductos eyaculadores. Esta última se sospecha cuando el semen tiene un pH < 7.2 con baja fructosa (ausencia del aporte alcalino, rico en fructosa, de las vesículas seminales) (5).
Oligozoospermia se define como una concentración espermática bajo el percentil 5 (15 millones/ml), y puede estar reflejando múltiples condiciones. No se debe diagnosticar azoospermia (ausencia de espermatozoides en el eyaculado) hasta centrifugar la muestra. Si posteriormente se confirma la ausencia de espermatozoides, se debe continuar el estudio para diferenciar si es que se está frente a una azoospermia obstructica (OA) o no obstructiva (NOA) (1,3,5).
La presencia de leucocitozoospermia (>1 millón de leucocitos/ml) puede estar reflejando una infección genitourinaria. La anamnesis, examen físico y estudios microbiológicos específicos podrán confirmar el diagnóstico. En el análisis seminal no se debe considerar como sinónimos las células redondas y los leucocitos, ya que las primeras también reflejan la presencia de células germinales inmaduras en el eyaculado.
Astenozoospermia se define, según los criterios de OMS 2010, como una movilidad progresiva menor a 32%. Es una variable inespecífica, que puede estar en el contexto de varicocele, defectos espermáticos ultraestructurales, anticuerpos anti-espermáticos, o puede ser idiopática (5).
Teratozoospermia se define como menos de 4% de formas normales, pero actualmente su utilidad como factor pronóstico en tratamientos de reproduccón asistida (TRA) es muy controversial (7,8). Ultimas publicaciones no muestran relacion entre Morfologia espermatica y éxito en Inseminaciones intrauterinas (IIU). (Tabla 4)
| Alteraciones espermiograma | |
| Azoospermia | Ausencia de espermatozoides en el eyaculado |
| Oligozoospermia | Concentración <15.000.000/ml |
| Astenozoospermia | Motilidad progresiva <32% |
| Teratozoospermia | Morfología <4% |
Tabla 4. Definiciones de las alteraciones en espermiograma
Para explicar de manera más didáctica al paciente su espermiograma sugerimos hacer el ejercicio de ponerle nota al espermiograma, tomando al p50 como nota 7.0 y al p5 como nota 4.0, como se muestra a continuación:
| Nota (percentil) | ||||
| Parámetro | 4.0 (p5) | 5.0 | 6.0 | 7.0 (p50) |
| Concentración espermática (mill/ml) | 15 | 30 | 45 | 73 |
| Motilidad Progresiva a+b (%) | 32 | 37 | 45 | 55 |
Considerando la gran variabilidad en los resultados del análisis seminal en un mismo paciente, en la evaluación del paciente que consulta por infertilidad se sugiere que se realicen dos espermiogramas separados por un plazo de aproximadamente 21 días. Si el primer espermiograma es normal, se puede omitir realizar un segundo examen.
Factores que pueden afectar la calidad seminal y son relevantes al momento de realizar e interpretar el espermiograma
|
Recogida: 1 sola muestra completa, rechazar informes de una muestra incompleta
Composición del líquido seminal: 1ª porción testículo-epidídimo 5%, Próstata 13-33% y 2ª porción vesículas seminales 40-80%). |
| Abstinencia sexual: Afecta el volumen y la concentración espermática, recomendar 3 a 5 días. |
| Variabilidad biológica: Considerar que intraindividuo existe 30% de variación, se requieren de 2 – 3 análisis separados aprox. 21 días para definir valores basales. |
| Fármacos: Existen varios que afectan la calidad seminal, sin embargo, considerar que los quimioterápicos la pueden alterar de manera irreversible. |
| Tóxicos-drogas pueden alterar calidad, ejemplos: Marihuana, heroína, metadona, cocaína, tabaco, alcohol crónico. |
| Factores ambientales pueden alterar calidad, ejemplos: Disruptores endocrinos bisfenoles/resinas epoxi, policarbonato, ftalatos, benzofenonas. |
| Otros factores que pueden afectar calidad: Ejercicio físico intenso, fiebre, estrés, exposición a altas temperaturas. |
| No olvidar: Espermatogénesis dura 74 días, por lo tanto, no evaluar cambios o resultados en tiempos inferiores. |
Evaluación endocrina
Las alteraciones del eje hipotálamo-hipófisis-gónadas son causas frecuentes de infertilidad masculina. Con una adecuada evaluación endocrina, se pueden diferenciar fallas testiculares primarias (hipogonadismo hipergonadotrófo) de fallas hipofisiarias o hipotalámicas (hipogonadismo hipogonadotrófo). Está indicada una evaluación básica con hormona folículo estimulante (FSH) y testosterona en todos los pacientes con alteraciones en el espermiograma, alteraciones de la función sexual o con hallazgos clínicos sugerentes de endocrinopatía (3).
Si el nivel de testosterona es bajo, se debe completar el estudio con hormona luteinizante (LH) y prolactina. Los micro y macroadenomas productores de prolactina son los tumores hipofisiarios más comunes, produciendo un efecto negativo sobre las células productoras de gonadotrofinas. La medición de prolactina será de especial importancia en pacientes con disminución del deseo, disfunción sexual, ginecomastia o galactorrea (5). Una FSH normal no garantiza una función testicular normal, sin embargo, una FSH elevada es indicativa de una falla en la espermatogénesis (1).
Análisis de orina post-eyaculación
Esta prueba se realiza centrifugando la muestra seminal por 10 minutos a 3000g, con posterior observación del pellet con una magnificación de 400x. La observación de un número significativo de espermatozoides es indicativa de eyaculación retrógrada (1).
Ecografía Doppler testicular y Resonancia Pelviana
Se debe realizar un eco-doppler testicular a los pacientes que consultan por infertilidad. Con este examen se podrá objetivar patología testicular, epididimaria o del cordón espermático. La ecografía testicular debe ser con modalidad doppler para objetivar la presencia o ausencia de varicocele.
La resonancia pelviana está indicada en el estudio de azoospermia u oligozoospermia de origen obstructivo. Se debe solicitar en pacientes con azoospermia u oligozoospermia severa con muestras seminales de bajo volumen, acidóticas, de baja fructosa. La visualización de vesículas seminales dilatadas (diámetro anteroposterior mayor a 2 cm), conductos eyaculadores dilatados o quistes prostáticos de línea media apoyan el diagnóstico de obstrucción parcial o completa de conductos eyaculadores (3,9).
Pruebas genéticas
Anormalidades cariotípicas y microdeleciones del cromosoma Y son comunes en pacientes con alteración de la espermatogénesis (3). Se observan alteraciones cromosómicas, como deleciones, translocaciones, duplicaciones e inversiones en el 6% de los hombres con infertilidad. Su transmisión a la descendencia puede resultar en abortos espontáneos, malformaciones congénitas, infertilidad masculina y una diversidad de síndromes genéticos.
El síndrome de Klinefelter (47 XXY) es, por mucho, la anormalidad cromosómica más diagnosticada en estos pacientes; 1 de cada 500-600 hombres en la población general presentan esta genopatía (5) y en azoospermias no obstructivas puede tener una frecuencia de 1 en 7 hombres
Manifestaciones Clinicas variadas y a veces, sutiles
Recien Nacido / Infancia: criptorquídea bilateral, pene pequeño, escroto bífido (poco frecuente), fisura paladar, cardiopatia congenita.
Etapa escolar: dislexia, problemas de lenguaje, dificultades de aprendizaje, descordinacion motora, problemas de interaccion social.
Pubertad/adolescencia: ginecomastia, testes pequeños y firmes, talla alta con tronco relativamente más corto que extremidades inferiores.
Adultos: infertilidad (el 10% de los pacientes azoospermicos tiene Sindrome de Klinefelter), hipogonadismo hipergonadotropo, diabetes tipo 1 y 2, sindrome metabólico, osteoporosis, tumores gonadales, tumores mediastinicos, cancer de mama (30 veces mas que 46 XY), linfoma, leucemia, trastornos inmunológicos.
El 92% de los pacientes con Síndrome de Klinefelter son azoospérmicos, la biopsia testicular bajo microscopio (microTESE) es la técnica con mejores tasas de éxito de recuperación espermática (recuperación en el 30-50% de los pacientes24). Realizar M-TESE en etapa puberal o post puberal inmediata para aumentar posibilidades de encontrar espermatozoides es una opción controversial con pros y contras que se debe evaluar caso a caso con el paciente y sus padres.
Es importante mencionar que este grupo de pacientes presenta múltiples comorbilidades, por lo que, aunque el paciente no desee fertilidad debe ser seguido por el equipo de salud.
Aproximadamente, el 10 a 13% de pacientes con azoospermia son portadores de una microdeleción del cromosoma Y (11). Pudiendo ser diagnosticada utilizando sequence tagged sites y reacción en cadena de la polimerasa. Su diagnóstico tiene implicancias pronósticas y éticas. La identificación de microdeleciones AZFa y AZFb se asocian a síndrome de Sertoli solo y detención de la maduración, no existiendo posibilidad de encontrar gametos viables con ninguna técnica de recuperación espermática. La microdeleción AZFc se asocia a oligozoospermia severa, existiendo un éxito cercano al 80% de recuperación espermática para su posterior utilización en ICSI. Esta mutación se transmitirá de forma invariable a la descendencia masculina, provocando infertilidad en estos individuos (12-14).
Se recomienda solicitar consejería genética, cariotipo y microdeleciones del cromosoma Y a todos los pacientes con azoospermia no obstructiva y oligozoospermia severa (< 5 millones por ml).
Dentro de las causas genéticas de infertilidad de tipo obstructivo, nos encontramos con la Agenesia Bilateral de Conductos Deferentes (ABCD). El diagnóstico es clínico, a través del examen físico no identificando los conductos deferentes. Generalmente los pacientes presentan tamaño testicular normal, en el espermiograma un bajo volumen seminal con azoospermia y la FSH se encuentra dentro de rangos normales. La frecuencia de ABCD es de 1:1600 hombres y todos los pacientes con FQ son portadores de ABCD. Una vez sospechado, es importante solicitar mutaciones del gen CFTR (Cystic Fibrosis Transmembrane Regulator gene). Setenta por ciento de los pacientes con ABCD sin síntomas o signos de fibrosis quística poseen una mutación del gen del receptor de conductancia transmembrana de fibrosis quística (CFTR) (15,16). Aunque se han descrito más de 1300 mutaciones para CFTR, las pruebas más utilizadas se basan en la búsqueda 50 mutaciones más comunes; por lo que un resultado negativo no es sinónimo de ausencia de una mutación. La mayoría de los pacientes con ABCD, presentan también hipoplasia o agenesia de vesículas seminales, y por esto presentan bajo volumen de eyaculado. En pacientes azoospérmicos con agenesia unilateral, la realización de una resonancia nuclear magnetica de pelvis puede confirmar atresia contralateral de conductos deferentes o vesículas seminales (3,17).
En los pacientes con estudio gentico positivo para CFTR es fundamental la evaluación de la presencia de la mutación en la pareja, si la pareja del paciente es portadora de la misma mutación que el paciente, la probabilidad de tener un hijo con FQ es de 25% si él es heterocigoto y 50% si es homocigoto. Si la pareja es negativa para mutaciones conocidas del gen la probabilidad de tener mutaciones desconocidas es de 0.4% En esas circunstancias la posibilidad de que un hijo tenga FQ si el padre es heterocigoto es de 1:700.
Por último, se debe indicar estudio ecográfico renal, a pacientes con agenesia unilateral de conductos deferentes, para identificar posibles malformaciones renales, y considerar secuenciar el gen CFTR completo en pacientes con ABCD con un panel de mutaciones negativo y una pareja femenina portadora de mutaciones del gen de la fibrosis quística.
Pruebas especializadas
Integridad del DNA: Se refiere al daño del ADN o material genético del espermatozoide. A diferencia del ovocito que posee un abundante citoplasma y capacidad de reparación del ADN, el espermatozoide tiene escasa o nula capacidad de reparación. Una vez dañado se le considera fragmentado y entrará en un proceso de apoptosis.
La fragmentación se informa como porcentaje, mientras menos mejor. Menor de 30% se considera normal, mayor de 30% anormal. Valores mayores a 30%, se asocian a menores tasas de embarazo en forma espontánea. En inseminación intrauterina y en algunos trabajos también la asocian a mayores tasas de aborto dentro de las primeras 8 semanas. En un 15% de los pacientes con espermiograma normal pueden existir valores aumentados de fragmentación del DNA. No existe un consenso definido sobre cuando solicitarlo, pero se sugiere a pacientes mayores de 45 años, quimioterapia reciente, infertilidad idiopática, falla al tratamiento de reproducción asistida, varicocele, exposicion a toxicos, infecciones seminales y aborto recurrente.
En la actualidad la fragmentación del DNA espermatico se ha consitituido en un examen de alto valor clinico que se solicita casi de rutina en la evaluacion del hombre infertil. Anatómicamente se considera que la fragmentación ocurre preferentemente en el epidídimo, es decir es un fenómeno post testicular, las etiologías son las mismas que el estrés oxidativo. Para bajar la fragmentación se debe identificar y tratar la etiología, en caso de ser idiopática, se sugiere intentar un tratamiento por 14 días con vitaminas y antioxidantes y bajar la abstinencia para el control a solo 12 horas.
Anticuerpos antiespermáticos: Las tasas de embarazo parecieran estar reducidas cuando existen anticuerpos antiespermáticos en el semen (22). Los factores de riesgo para presentar estos anticuerpos son obstrucción ductal, infecciones genitales, trauma testicular, cirugías testiculares/epididimarias y antecedentes de vasectomía. Se debe considerar solicitarlos en pacientes con astenozoospermia, aglutinación espermática o un test post-coital anormal (3).
Otras pruebas especializadas: Las pruebas de viabilidad espermática, mediante tinción supravital o test hipoosmótico, son útiles en pacientes con astenozoospermia; para diferenciar espermatozoides muertos de inmóviles, que podrían ser utilizados posteriormente en ICSI. El test post-coital es la examinación microscópica del mucus cervical, realizado antes de la ovulación, unas horas después de una relación sexual. Determina si los espermatozoides alcanzan y penetran la barrera del mucus cervical. Puede ser útil en casos de semen hiperviscoso, infertilidad no explicada, concentración espermática normal en eyaculados de alto o bajo volumen, y en los casos de anatomía peneana anormal (5).
Las pruebas de función espermática, como la prueba de penetración espermática, la evaluación de reacción acrosomal y la prueba de hemi-zona, evalúan la capacidad de adhesión y penetración de los espermatozoides en el ovocito. Pueden estar indicadas cuando se debe decidir la técnica de reproducción asistida más adecuada o cuando se está investigando la causa de fracasos recurrentes en reproducción asistida (3,5).
En el líquido seminal, leucocitos y espermatozoides defectuosos producen especies reactivas de oxígeno (ROS). Diversos estudios han postulado que el desbalance entre ROS y sustancias antioxidantes (estrés oxidativo) juega un rol fundamental en diversas condiciones relacionadas a infertilidad masculina, como el varicocele. Actualmente existen pruebas de laboratorio que cuantifican el daño oxidativo de diferentes estructuras espermáticas. La medición de 8-hidroxi-2-deoxiguanosina refleja la acción oxidante de ROS sobre el DNA espermático (3).
Tratamiento de causas modificables
Tratamiento del varicocele
Se define como una dilatación excesiva del plexo venoso pampiniforme del cordón espermático, que puede ser identificado clínicamente o a través de visualización de reflujo venoso en ecografía doppler. Frecuentemente aparece en la pubertad. La prevalencia es de 12 a 15% de los adolescentes masculinos (80% a izquierda / 18% bilateral / 2% derecho). Se considera la causa, corregible quirúrgicamente, más frecuente de infertilidad masculina (1).
En su etiología, se destaca el aumento de presión en la vena renal izquierda causada por anastomosis venosas colaterales e incompetencia valvular. Anatómicamente, la vena espermática izquierda drena a la vena renal izquierda, mientras que la vena espermática derecha drena directamente en la vena cava.
El varicocele se puede clasificar en:
Subclínico: No se puede observar ni palpar. Sólo se identifica con ecodoppler testicular
Grado 1: Palpable sólo con maniobra de valsalva
Grado 2: Palpable en reposo, pero no visible
Grado 3: Visible y palpable en reposo
Características fisiopatológicas:
La Tº escrotal ideal es de 33º. Con varicocele puede subir 0.5ºC hasta 2ºC
El aumento de la Tº escrotal puede:
- Aumentar apoptosis de células espermatogénicas.
- Alterar la esteroidogénesis intra-testicular.
- Alterar la célula de Sertoli.
El reflujo venoso por la incompetencia valvular puede:
- Aumentar la presión intratesticular limitando flujo arterial.
- Producir estasis venosa.
- Desencadenar reflujo de catecolaminas desde glándula suprarrenal.
El estrés oxidativo puede:
Aumentar la apoptosis de células espermatogénicas
Aumentar la fragmentación del DNA espermático
En pacientes infértiles, el patrón clásico del espermiograma muestra disminución de la concentración, movilidad y aumento de las formas anormales de los espermatozoides (oligoastenoteratozoospermia).
El tratamiento del varicocele ha sido durante años un tema controversial en urología. La cirugía mejora los parámetros del espermiograma en el 70% de los pacientes con varicocele palpable. En los meta-analisis se ha demostrado impacto positivo sobre: concentracion, motilidad, fragmentacion del DNA y estrés oxidativo, pero su real utilidad en aumentar la tasa de recién nacidos no ha sido demostrada (23).
El tratamiento es quirúrgico y las indicaciones de cirugía son:
- Disminución del tamaño del testículo afectado por el varicocele (≥ 20%). Esta indicacion es solo aplicable en adolescentes.
- Dolor atribuible al varicocele.
- Infertilidad asociada a alteración del espermiograma.
Existen múltiples alternativas terapéuticas, entre las que se encuentran: escleroterapia, embolización y varicocelectomía escrotal, inguinal, ligadura alta, subinguinal, microquirúrgica (inguinal y subinguinal) y laparoscópica. Las menores tasas de persistencia y recurrencia, y los mejores resultados en cuanto a parámetros seminales, atrofia testicular e hidrocele post-operatorio, se observan con la técnica microquirúrgica. Diversos estudios han informado mejores resultados en la tasas de embarazo con esta técnica (1,24-26).
Técnicas quirúrgicas de varicocelectomía
SupraInguinal – Ivanissevich: Descrita en 1918. Se liga paquete venoso a la altura del anillo inguinal interno. Tasa de hidrocele = 7%, Tasa de recidiva = 3%
Inguinal – Bernardi: Descrita en 1941. Se liga paquete venoso a la altura del canal inguinal. Tasa de hidrocele = 7%, Tasa de recidiva = 3%
Retroperitoneal – Palomo: Descrita en 1949. Se liga paquete venoso sobre el psoas, en retroperitoneo. Tasa de hidrocele = 8%, Tasa de recidiva = 15%
Subinguinal – Marmar (sin microscopio): Descrita en 1985. Se liga paquete venoso bajo el anillo inguinal externo. Tasa de hidrocele = 7%, Tasa de recidiva = 3%
Subinguinal Microquirúrgica – Goldstein: Descrita en 1992. Se liga paquete venoso bajo el anillo inguinal externo. Tasa de hidrocele = 0.5%, Tasa de recidiva = 1%
Laparoscópica – Winfield: Descrita en 1991. Se liga paquete venoso vía transperitoneal. Tasa de hidrocele = 3%, Tasa de recidiva = 4%
Tratamiento del hipogonadismo
Testosterona disminuida, asociada a valores bajos de FSH y LH son compatibles con hipogonadismo hipogonadotrófo, pudiendo ser congénito (ej. síndrome de Kallman), adquirido (ej. tumores hipofisiarios) o idiopático. Adenomas hipofisiarios productores de prolactina son una causa frecuente de esta condición, pudiendo ser tratados con agonistas dopaminérgicos como carbegolina (5).
En pacientes hipogonádicos, se puede establecer una espermatogénesis normal con terapia de reemplazo de gonadotrofinas (5). La acción de FSH sobre las células de sertoli se puede reemplazar con gonadotropina menopáusica humana o con FSH recombinante. La acción de LH sobre las células de Leydig se puede sustituir con gonadotrofina coriónica humana (5).
En pacientes con testosterona baja, y gonadotrofinas elevadas, se debe realizar el diagnóstico de falla testicular. No se debe implementar una terapia de reemplazo androgénica, ya que la testosterona exógena inhibirá la espermatogénesis. Se debe buscar la causa de la falla testicular primaria. Algunas de éstas tienen tratamiento específico, otras permiten la recuperación espermática para posterior reproducción asistida, y otras no permiten obtener gametos viables por lo que la adopción o utilización de semen de donante deben ser consideradas (5). Un grupo específico de estos pacientes presentan niveles de estradiol elevados, pudiendo ser tratados con inhibidores de aromatasa. Estudios han demostrado una mejoría significativa de los parámetros seminales con este tratamiento (27).
Habitualmente los pacientes con Hipogonadismo Hipogonadotropo adquirido logran espermatozoides en semen con un 90% a 95% de probabilidad a los 12 meses, y muchos de ellos logran adecuados recuentos espermáticos. Los pacientes con Hipogonadismo Hipogonadotropo congénito logran espermatozoides en semen con un 70% a 85% de probabilidad y en general logran recuentos bajos y pueden demorar 18 o más meses en lograrlos
Tratamiento de azoospermia obstructiva
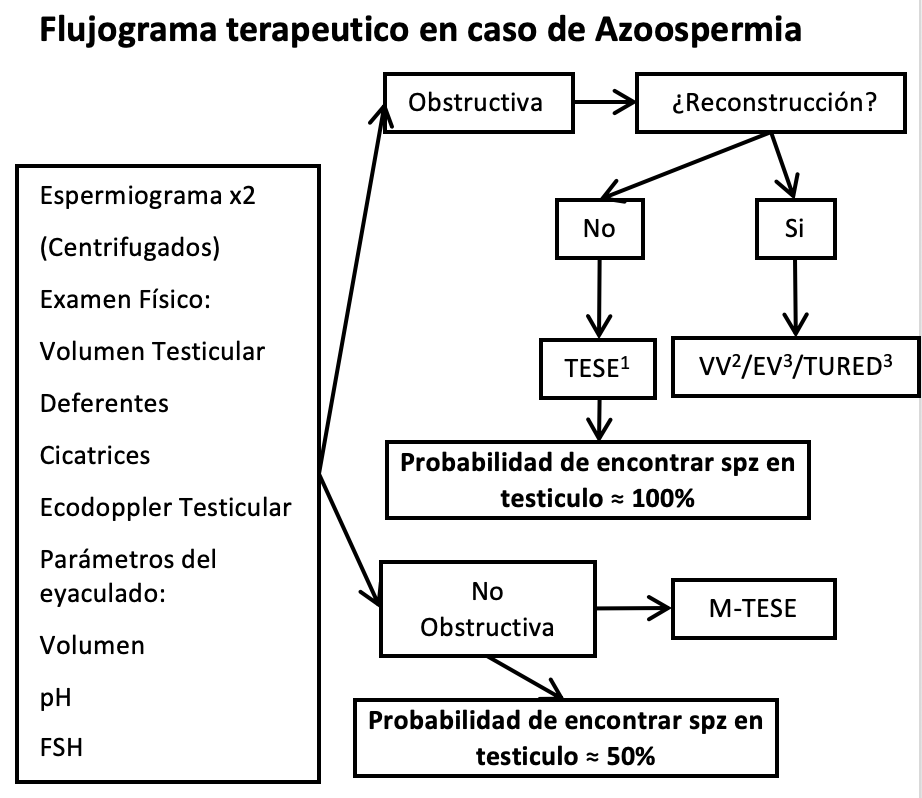
El 40% de las azoospermias se incluyen en este grupo. La obstrucción puede ser intratesticular, epididimaria, deferencial o en los conductos eyaculadores. Se observan testículos de tamaño normal, epidídimos dilatados, bajo volumen seminal y FSH normal. Los dos principales tratamientos incluyen la corrección quirúrgica y la recuperación espermática seguida de ICSI. En casos de obstrucción epididimaria o deferencial, el sitio preciso de obstrucción puede ser determinado a través de una vesiculo-deferentografía o exploración quirúrgica. La cirugía de corrección debe ser realizada por un cirujano con experiencia en microcirugía. Las tasas de presencia de espermatozoides en el eyaculado son de 80%-90% para la vasovasostomía (reversión de la vasectomía) y de 40%-60% para la epididimovasostomía. Si la obstrucción está ubicada en los conductos eyaculadores, la cirugía de elección es la resección transuretral (Video adjunto).
La recuperación espermática para ICSI es la terapia de elección cuando existen factores femeninos que requieren reproducción asistida, cuando la reconstrucción es imposible (como en ABCD) o cuando fracasan las técnicas de corrección. Se utilizarán diferentes técnicas, como la aspiración espermática microquirúrgica desde epidídimo (MESA), la aspiración espermática percutánea desde epidídimo (PESA) o la extracción espermática desde testículo (TESE), dependiendo del sitio de obstrucción y la experiencia del cirujano (1,28).
Tratamiento de azoospermia no obstructiva (NOA)
La NOA refleja un daño severo de la espermatogénesis. Se caracteriza clínicamente por testículos pequeños y blandos, asociados a FSH elevada. Múltiples condiciones que producen falla testicular, tienen como producto final la NOA. Su tratamiento se ha revolucionado desde que se describió TESE, pudiéndose optimizar al realizarla con microdisección (m-TESE). En esta técnica, se pueden reconocer visualmente los túbulos seminíferos que más probablemente contienen espermatozoides, para su posterior extracción (29). Las tasas de recuperación exitosa son de 35%-63%, dependiendo de la etiología de la NOA y la experiencia del cirujano (30). En pocas patologías se puede predecir de forma irrefutable el fracaso de TESE, las microdeleciones completas de las zonas AZFa y AZFb del cromosoma Y son una de ellas (5). (Figura 1)

Tratamiento de las disfunciones sexuales y eyaculatorias
Las disfunciones sexuales pueden interferir con las relaciones sexuales y/o eyaculación intravaginal. Trastornos del deseo, asociados a baja testosterona, pudieran ser tratados con moduladores del receptor de estrógenos (clomifeno o tamoxifeno), inhibidores de aromatasa o gonadotrofina coriónica humana. La disfunción eréctil puede ser tratada con inhibidores de fosfodiesterasa 5 o inyecciones intracavernosas (5).
En el caso de eyaculación retrógrada, se pueden utilizar agentes simpaticomiméticos como efedrina o imipramina; o se pueden recuperar espermatozoides desde orina post-eyaculación. Para pacientes aneyaculatorios, se puede utilizar estimulación peneana vibratoria, electroeyaculación transrectal o recuperación espermática quirúrgica (31-33).
Tratamiento antioxidante
El tratamiento con antioxidantes orales se basa en múltiples estudios que demuestran una mayor concentración de ROS y sus productos de degradación, en plasma seminal de pacientes infértiles, con alteración de diferentes parámetros seminales. Una revisión Cochrane del año 2012 que incluyó 34 estudios con 2876 parejas, demostró que la terapia con antioxidantes orales aumenta la tasa de embarazos y recién nacidos vivos, sin aumentar los efectos adversos (35). Entre los agentes utilizados, los con mayor evidencia son la L-carnitina, vitamina C, vitamina E y Conezima Q10. Las dos últimas, utilizadas en conjunto, lograrían proteger a las estructuras espermáticas lipídicas (vitamina E) e hidrofílicas (vitamina C), frente al ataque de ROS.
Conclusiones
Existe un factor masculino en aproximadamente la mitad de las parejas infértiles. La adecuada evaluación del paciente con anamnesis, examen físico, espermiograma y exámenes básicos de laboratorio, permitirá identificar las condiciones que tienen tratamiento específico; las que no tienen tratamiento, pero permiten recuperar gametos viables; las que no permitirán recuperar espermatozoides, debiendo asesorar en relación a adopción o utilización se semen de donante; y las condiciones que pueden poner en riesgo la vida del paciente. En los últimos años, el desarrollo de diferentes técnicas de recuperación espermática e ICSI, han permitido que pacientes con severas alteraciones de la espermatogénesis o del transporte espermático, puedan tener descendencia. La elección de la técnica más adecuada, con la mayor tasa de éxito, depende de haber logrado un diagnóstico específico correcto.
Bibliografía
- Jungwirth A, Giwercman A, Tournaye H, et al. European Association of Urology guidelines on Male Infertility: the 2012 update. Eur Urol 2012; 62:324-32
- Thonneau P, Marchand S, Tallec A, et al. Incidence and main causes of infertility in a resident population (1,850,000) of three French regions (1988-1989). Hum Reprod 1991; 6:811
- Jarow J, Sigman M, Kolettis P, et al. The Optimal Evaluation of the Infertile Male: AUA Best Practice Statement. American Urological Association Education and Research 2010
- Rowe T. Fertility and a woman’s age. J Reprod Med 2006; 51:157-63
- Stahl P, Stember D, Goldstein M. Annu Rev Med 2012; 63:525-540
- WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction; 4th edition, Cambridge University Press, 1999
- Grigoriou O, Pantos K, Makrakis E, et al. Impact of isolated teratozoospermia on the outcome of intrauterine insemination. Fertil Steril 2005; 83:773–75
- French DB, Sabanegh ES Jr, Goldfarb J, et al. Does severe teratozoospermia affect blastocyst formation, live birth rate, and other clinical outcome parameters in ICSI cycles? Fertil Steril 2010; 93:1097–103
- Jarow JP. Transrectal ultrasonography of infertile men. Fertil Steril 1993; 60:1035
- Williams DH 4th, Karpman E, Sander JC, Spiess PE, Pisters LL, Lipshultz LI. Pretreatment semen parameters in men with cancer. J Urol 2009; 181:736-40
- Reijo R, Alagappan RK, Patrizio P et al: Severe oligozoospermia resulting from deletions of azoospermia factor gene on Y chromosome. Lancet 1996; 347:1290
- Hopps CV, Mielnik A, Goldstein M et al: Detection of sperm in men with Y chromosome microdeletions of the AZFa, AZFb and AZFc regions. Hum Reprod 2003; 18:1660
- Silber SJ and Repping S: Transmission of male infertility to future generations: Lessons from the Y chromosome. Hum Reprod Update 2002; 8:217
- Foresta C, Moro E and Ferlin A: Y chromosome microdeletions and alterations of spermatogenesis. Endocr Rev 2001; 22:226
- Anguiano A, Oates RD, Amos JA et al: Congenital bilateral absence of the vas deferens. A primarily genital form of cystic fibrosis. JAMA 1992; 267:1794
- Chillon M, Casals T, Mercier B et al: Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens. New Engl J Med 1995; 332: 1475
- Hall S and Oates RD: Unilateral absence of the scrotal vas deferens associated with contralateral mesonephric duct anomalies resulting in infertility: laboratory, physical and radiographic findings, and therapeutic alternatives. J Urol 1993; 150:1161
- Spano M, Bonde JP, Hjollund HI, et al. Sperm chromatin damage impairs human fertility. The Danish First Pregnancy Planner Study Team. Fertil Steril 2000; 73:43–50
- Bungum M, Humaidan P, Axmon A, et al. SpermDNA integrity assessment in prediction of assisted reproduction technology outcome. Hum Reprod 2007; 22:174–79
- Collins JA, Barnhart KT, Schlegel PN. Do sperm DNA integrity tests predict pregnancy with in vitro fertilization? Fertil Steril 2008; 89:823–31
- Zini A, Boman JM, Belzile E, et al. Sperm DNA damage is associated with an increased risk of pregnancy loss after IVF and ICSI: systematic review and meta-analysis. Hum Reprod 2008; 23:2663–68
- Ayvaliotis B, Bronson R, Rosenfeld D et al. Conception rates in couples where autoimmunity to sperm is detected. Fertil Steril 1985; 43:739
- Baazeem A, Belzile E, Ciampi A, et al. Varicocele and male factor infertility treatment: a new metaanalysis and review of the role of varicocele repair. Eur Urol 2011; 60:796-808
- Abdel-Meguid TA, Al-Sayyad A, Tayib A, Farsi HM. Does varicocele repair improve male infertility? An evidence-based perspective from a randomized, controlled trial. Eur Urol 2011; 59:455-61
- Evers JL, Collins JA, Vandekerckhove P. Surgery or embolisation for varicocele in subfertile men. Cochrane Database Syst Rev. 2001;(1):CD000479.
- Cayan S, Shavakhabov S, Kadioğlu A. Treatment of palpable varicocele in infertile men: a meta-analysis to define the best technique. J Androl 2009; 30:33-40
- Raman JD, Schlegel PN. Aromatase inhibitors for male infertility. J Urol 2002; 167:624–29
- Silber SJ, Balmaceda J, Borrero C, et al. Pregnancy with sperm aspiration from the proximal head of the epididymis: a new treatment for congenital absence of the vas deferens. Fertil Steril 1988; 50:525-8
- Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999; 14:131–35
- Carpi A, Sabanegh E, Mechanick J. Controversies in the management of nonobstructive azoospermia. Fertil Steril 2009; 91:963–70
- Hendry WF. Disorders of ejaculation: congenital, acquired and functional. Br J Urol 1998; 82:331-41
- Mahadevan.M., Leeton,J.F. and Trounson.A.O. Noninvasive method of semen collection for successful artificial insemination. Fertil Steril 1981; 36:243-247
- Yavetz H, Yogev L, Hauser R. Retrograde Ejaculation. Human Reprod 1994; 9:381-6
- Lombardo F, Sansone A, Romanelli F, Paoli D, Gandini L, Lenzi A. The role of antioxidant therapy in the treatment of male infertility: an overview. Asian J Androl. 2011; 13(5):690-7
- Showell MG, Brown J, Yazdani A, Stankiewicz MT, Hart RJ. Antioxidants for male subfertility. Cochrane Database Syst Rev. 2011 Jan 19;(1):CD007411
