Capítulo 29
Cáncer de testículo
- Dr. Luis Ebel S., Dr. Andrónico Fonerón B.,
- Dr. Luis Troncoso S., Dr. Alejandro Fonerón V.
- Hospital de Valdivia- Universidad de Valdivia
Antecedentes y epidemiologia
El cáncer de testículo representa el 1 – 1.5 % de las neoplasias masculinas, y el 5% de los tumores urológicos del hombre. No obstante, es el tumor sólido más frecuente de los hombres jóvenes, especialmente entre los 20-34 años. Su incidencia a nivel mundial ha aumentado en las últimas 6 décadas en la mayoría de los países industrializados, con diferencias sorprendentes en las tasas de incidencia, incluso entre países vecinos, siendo actualmente de 3.5‑9.7 casos nuevos por 100.000 hombres/año en la sociedad occidental, especialmente en países nórdicos (Fig.1). En los EEUU de América, por ejemplo, es 5.7/100.000/hombres al año, aumentando 0.8%/año en la última década; 1 de cada 250 hombres será diagnosticado de cáncer testicular en ese país (1,2).
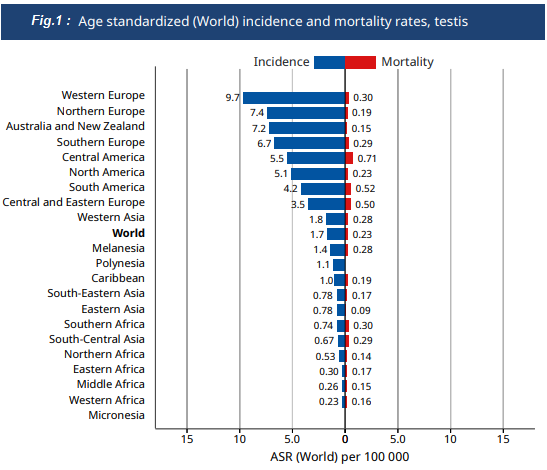

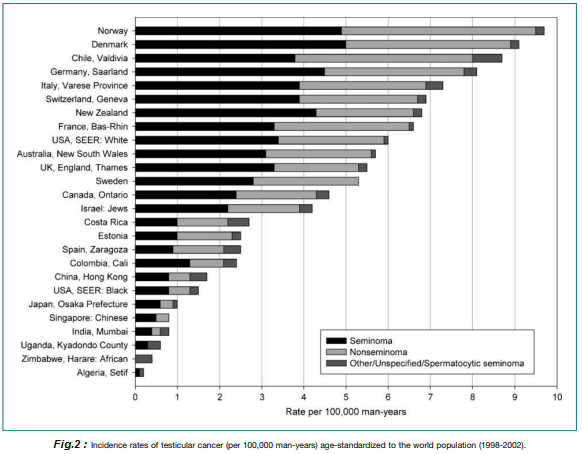
En Chile, el cáncer de testículo se ubica en la séptima posición entre los cánceres del hombre, con una tasa bruta de 8 por 100.000 habitantes y una tasa ajustada de 7,2. En 2010 un estudio que evaluó los datos de los registros poblacionales de cáncer a nivel mundial para el periodo 1998-2002, publicó una incidencia de cáncer testicular en Valdivia, Región de los Ríos, de 8,8 x 100.000/hombres, la más alta entre los países de Centro y Sudamérica (Fig.2). En la misma Región hubo una tasa bruta de 9.9 – 15.6 por 100.000 hombres/año y una tasa estandarizada de 9.5 – 15.8 por 100:000 hombres/año entre los años 2000-2014, con un promedio de 12.5 y 12, respectivamente (3,4). En la Región de la Araucanía se reportó incidencia entre 6-10 casos/100.000 hombres entre los años 1992-2002 y en la Provincia de Ñuble 4.3-8.2 entre los años 1995-2004 (5,6).

Respecto al tipo histológico, el 90-95% de ellos son derivados de las células germinales del testículo, con tipos histológicos tanto seminomas como no-seminomas o mixtos; el 5% de los tumores de células germinales son extragonadales, y pueden desarrollarse en el mediastino, retroperitoneo (RTP) o cerebro. Los tumores no seminomas tienen su incidencia máxima en el 3er.decenio de la vida y los tumores seminomas en la 4ta. década. La incidencia de tumores bilaterales es 1-5%, generalmente asincrónicos (2).
El tratamiento de esta enfermedad es un ejemplo de manejo multimodal del cáncer y tiene altos índices de curación, tanto por el tratamiento, basado en quimioterapia (QMT), como por el seguimiento estricto y terapias exitosas de salvataje. Por ello, su mortalidad es baja y se ha mantenido estable a nivel mundial durante la últimos años (0.15-0.71 por 100.000 hombres/año). Las tasas de mortalidad más altas se observan en Latinoamérica; en Chile fue 1-1.4/100.000 hombres/año entre 2000-2015 (7).
La sobrevida a 5 años para la enfermedad localizada al testículo, con diseminación a ganglios regionales o con metástasis a distancia es 99%, 96% y 73%, respectivamente (8).
Factores de riesgo
• Carcinoma in situ (CIS): es la lesión precursora de la mayoría de los tumores de células germinales en el testículo y se encuentra en el parénquima adyacente de tumores invasores en el 80-90% de los casos. En presencia de CIS el riesgo de desarrollar un tumor de células germinales en el mismo órgano es 50% a 5 años.
• Alteraciones genéticas: en todos los tipos histológicos de tumores de células germinales y en CIS se ha puntualizado un marcador genético específico (isocromosoma del brazo corto del cromosoma 12 (12p). Se ha asociado también con alteración del locus de p53, gen supresor PTEN, desregulación del programa pruripotencial de las células germinales a través de marcadores específicos (M2A, C-KIT y OCT4/NANOG) y polimorfismo único de nucleótidos (9).
•Antecedentes de criptorquídea: existe un riesgo de 4-6 veces mayor de presentar un tumor en ese testículo, que disminuye a la mitad si la orquidopexia se realiza antes de la pubertad. El riesgo del testículo contralateral es levemente mayor (riesgo relativo 1.74) (10).
•Antecedentes familiares: hay un riesgo mayor en familiares de primer grado (hermanos/hijos) y a edades menores. No obstante, un pequeño número de cánceres de testículo ocurre entre las familias. La mayoría de los hombres con cáncer testicular no tiene antecedentes familiares de esta enfermedad (11).
•Cáncer en el testículo contralateral: el riesgo aumenta hasta 12 veces, pero la incidencia acumulada a 15 años es sólo 2%.
•Edad: Alrededor de la mitad de los tumores de los testículos se presentan entre los 20 y 34 años de edad. Sin embargo, este cáncer puede afectar a hombres de cualquier edad, incluyendo niños y pacientes mayores.
•Raza y origen étnico: El riesgo para hombres de raza blanca es aproximadamente 4-5 veces mayor que en los de raza afro-americana y más de 3 veces que los asiático-americanos. El riesgo para los hispanolatinos y los indios americanos se encuentra entre el de los asiáticos y los de raza blanca no hispanos. Se desconoce la razón de esta diferencia.
•Estatura: Varios estudios han encontrado que el riesgo de cáncer testicular es un poco mayor en los hombres de estatura alta, aunque otros no lo han demostrado. Una revisión sistemática reciente demostró un riesgo relativo de 1.13 por cada 5 cms. de aumento de la estatura.
•Alteraciones de la fertilidad: hombres con alteraciones de la fertilidad son 1.3 veces más propensos a desarrollar cáncer testicular. La posible explicación para esta relación es una causa común que subyace a ambos trastornos (Síndrome de Disginesia Testicular). Factores ambientales y los fallos en el proceso de reparación del ADN podrían contribuir a ambas condiciones (12).
Diagnóstico
La forma más frecuente de presentación del cáncer testicular es el aumento de volumen indoloro de la glándula o la palpación de un nódulo dentro de ésta. Sin embargo, muchas veces el paciente sólo tiene sensación de pesadez del testículo. En pocas ocasiones el paciente acude por dolor de inicio súbito, lo cual traduce hemorragia o necrosis dentro del tumor.
El 10% consulta por síntomas de metástasis, que pueden incluir presencia de masa supraclavicular, síntomas respiratorios (disnea, tos persistente, hemoptisis), dolor lumbar, síntomas neurológicos, edema de extremidades inferiores, síntomas digestivos (náusea, vómitos, anorexia). Ocasionalmente un traumatismo escrotal revela la presencia de un tumor testicular. La ginecomastia es de baja ocurrencia (7%); no siempre se relaciona con elevación de Gonadotrofina Coriónica Humana (HCG) y es más frecuente en tumores no-seminomas.
En el examen físico se debe tener especial cuidado al evaluar el contenido escrotal, comenzando por el testículo sano de modo de tener elementos de referencia. En el testículo afectado podemos encontrar un aumento de volumen homogéneo o duro e irregular, o palparse un nódulo intratesticular. El epidídimo y el cordón espermático en pocas ocasiones se encuentran comprometidos y se palpan separados del testículo. Puede existir hidrocele secundario, lo que puede hacer difícil el examen.
El examen de cuello puede evidenciar una masa supraclavicular y en el tórax se deben buscar ginecomastia y signos de dificultad respiratoria. La palpación del abdomen puede revelar una masa que evidencia metástasis retroperitoneal (RTP). El edema de extremidades inferiores es un hallazgo infrecuente que se produce por compresión de la vena cava o bloqueo linfático.
Imagenología testicular
Habitualmente la ecografía sirve para confirmar el diagnóstico y debe hacerse en todos los pacientes con sospecha de cáncer testicular. Los tumores de células germinales son habitualmente heterogéneos e hipoecoicos. Debe ser efectuada también en hombres jóvenes sin masa testicular palpable con masa RTP o masa visceral o HCG/alfa-fetoproteína (AFP) elevadas. La ecografía puede ser recomendada en el seguimiento de pacientes en riesgo cuando otros factores diferentes a la microlitiasis están presentes (tamaño testicular < 12 cc o atrofia, parénquima no homogéneo). La presencia sólo de microlitiasis no es indicación de seguimiento.
La resonancia magnética (RM) tiene mayor sensibilidad y especificidad que la ecografía y está indicada cuando la ecografía de las masas testiculares es de diagnóstico incierto. El seguimiento de las lesiones testiculares sospechosas de neoplasia debe hacerse con RM.
Marcadores tumorales en el diagnóstico
Los marcadores tumorales tienen valor pronóstico y contribuyen al diagnóstico y la etapificación. Los siguientes marcadores deberían determinarse:
• AFP, producida por las células Yolk sac
• β-HCG, expresión de trofoblastos
• Deshidrogenasa Láctica (LDH)
Hay una elevación de los marcadores en 51% de los casos. AFP está aumentada en 50-70% de los pacientes con cáncer no -seminoma y HCG en 40-60% de ellos. Alrededor del 90% tiene uno o dos de los marcadores elevados. Más del 30% de los seminomas pueden tener o desarrollar un alza de la HCG durante el curso de la enfermedad. La LDH es un marcador menos específico y su concentración está en relación al volumen tumoral, puede estar elevada en 80% de los pacientes con un cáncer avanzado.
Orquiectomía
Todo paciente con una masa testicular sospechosa de malignidad debe ser sometido a exploración por vía inguinal, lo cual permite seccionar el cordón espermático a nivel del anillo inguinal profundo al momento de la orquiectomía, extirpando así las vías de diseminación del tumor. Puede ser necesaria una biopsia por congelación si existen dudas acerca de la naturaleza de la lesión. No se debe hacer orquiectomía ni biopsia transescrotal ya que se altera la vía de diseminación linfática del testículo, aumentando la posibilidad de recurrencia local y eventuales metástasis a ganglios inguinales y pélvicos como primera estación.
La orquiectomía ampliada por vía inguinal, además de permitir el estudio histológico y establecer las características del tumor primario, es curativa para el 70 a 85% de todos los pacientes.
La tumorectomía para conservar parénquima testicular, aunque controvertida, puede considerarse en pacientes con tumor bilateral sincrónico o tumor en testículo único. La lesión debe medir menos de 2 centímetros y en todos los casos debe existir testosterona normal. Otros señalan que el tumor debe ser menor al 30% del volumen total del testículo para poder tomar esta opción quirúrgica. Se aconseja que estos pacientes reciban radioterapia (RDT) adyuvante por el alto riesgo de desarrollar un nuevo tumor (13).
Etapificación clínica
El tratamiento del cáncer de testículo está determinado por la etapificación clínico-patológica de la enfermedad, basada en las características patológicas del tumor, la extensión de las metástasis (si existen) y el nivel de los marcadores tumorales post-orquiectomía.
La vía linfática es la forma más frecuente de diseminación y la primera estación son los ganglios del RTP, desde T1 a L4, concentrándose a nivel del hilio renal debido al origen embriológico del testículo. Para los tumores derechos el sitio primario son los ganglios intercavo-aórticos, por debajo de los vasos renales, seguidos por los para-cavos y para-aórticos. Para los tumores izquierdos la primera estación son los ganglios para-aórticos y luego los intercavo-aórticos. El coriocarcinoma escapa a estas reglas ya que tiene diseminación preferentemente hematógena y las metástasis pulmonares son precoces.
La evaluación con imágenes de RTP está indicada en todos los pacientes portadores de un cáncer testicular. La tomografía computada (TAC) de abdomen y pelvis es el examen de elección para este propósito. La TAC puede demostrar metástasis linfáticas en el 10 a 20% de los seminomas y 60 a 70% de los tumores no-seminomas. Sin embargo, los falsos negativos son 25-30%. Estos pacientes progresaran sin un tratamiento adicional. RM no ha demostrado ser superior a TAC en la etapificación del RTP: puede ser útil cuando TAC no es concluyente o si existen limitaciones para la irradiación del paciente.
La evaluación del tórax es diferente según el tipo histológico y los resultados de TAC de abdomen y pelvis. Para los tumores seminomas con TAC de abdomen y pelvis normal, una radiografía (Rx) frontal y lateral del tórax es suficiente, ya que la posibilidad de encontrar metástasis es muy baja. Sin embargo, cuando se trata de tumores no-seminomas o seminomas con compromiso ganglionar RTP o marcadores elevados post-orquiectomía, está indicada la TAC de tórax ya que este es el examen más sensible para evaluar el tórax y mediastino. Hasta el 10% de los tumores no-seminomas con el RTP normal puede tener compromiso torácico.
La evaluación del cerebro con TAC sólo está indicada en presencia de metástasis pulmonares múltiples, síntomas neurológicos o HGC mayor de 5.000 U/l, ya que esta condición se asocia frecuentemente a metástasis de coriocarcinoma.
No hay evidencia que apoye el uso de PET-SCAN en la etapificación del cáncer testicular (14,15).
Etapificación
El sistema recomendado es TNM de 2018. 8ª edición de la UICC (International Union Against Cancer) (16).
pT Tumor primario
pTx Tumor primario no evaluable.
pT0 No hay evidencia de tumor primario (ej: cicatriz histológica en el testiculo).
pTa Carcinoma papilar no invasivo.
pTis Carcinoma germinal intratubular ( CIS).
pT1 Tumor limitado al testículo y epidídimo sin invasión vascular/linfática. El tumor puede invadir la albugínea pero no la vaginal.
T2 Tumor limitado al testículo y epidídimo con invasión vascular/linfática o tumor extendiéndose a través de la túnica albugínea con compromiso de la túnica vaginal.
pT3 Tumor invade cordón espermático con o sin invasión vascular/linfática.
pT4 Tumor invade escroto con o sin invasión vascular/linfática
N Ganglios regionales clínicos
NX Ganglios regionales no pueden ser evaluados.
N0 Sin metástasis en ganglios regionales.
N1 Metástasis en un ganglio ≤ 2 cms. ó múltiples ganglios, ninguno > 2 cms.
N2 Metástasis en un ganglio > 2 cms. pero no > de 5 cms. o ganglios múltiples, pero ninguna masa < de 2 cms. ni > 5 cms., o evidencia de extensión extranodal de tumor.
N3 Metástasis con un ganglio > 5 cms.
pN Ganglios regionales patológicos
pNX Ganglios regionales no pueden ser evaluados
pN0 Sin metástasis en ganglios regionales
pN1 Metástasis en un ganglio ≤ 2 cms., ninguno > de 2 cms.
pN2 Metástasis en un ganglio > de 2 cm pero no > de 5 cm o más de 5 ganglios positivos ninguno > de 5 cm o evidencia de extensión extraganglionar del tumor.
pN3 Metástasis con un ganglio > de 5 cms.
M Metástasis a distancia
MX Metástasis a distancia no pueden ser evaluadas.
M0 Sin metástasis a distancia.
M1 Metástasis a distancia.
M1a Metástasis en ganglios no regionales o pulmonares.
M1b Otros sitios.
S Marcadores tumorales séricos
SX Estudio no adecuado o no efectuado.
S0 Estudio dentro de límites normales.
LDH (U/l) HCG (mUI/ml) AFP (ng/ml)
S1 < 1.5 x N y < 5.000 y < 1.000
S2 1.5 – 10x N o 5.000-50.000 o 1.000 – 10.000
S3 > 10 x N o > 50.000 o > 10.000
Subetapas pronósticas
Etapa I Tumor localizado en el testículo, sin evidencia de metástasis y marcadores tumorales negativos post-orquiectomía.
Etapa IIA Tumor con marcadores tumorales positivos post-orquiectomía y/o ganglios RTP positivos pero < de 2 cms.
Etapa IIB Tumor con ganglios RTP positivos ≥ 2 cm o más pero > de 5 cm
Etapa IIC Tumor con ganglios RTP ≥ 5 cms.
Etapa IIIA Tumor con ganglios supraclaviculares o metástasis sólo en 1 pulmón pero ninguna > 2 cms.
Etapa IIIB Tumores con ganglios en ambos pulmones y/o metástasis viscerales
IGCCCG (International Germ Cell Cancer Collaborative Group)
Etapifica cánceres testiculares metastásicos basado en factores clínicos adversos independientes: histología, ubicación inicial de las metástasis y niveles de los marcadores tumorales pre QMT.
Esta clasificación ha sido incorporada al TNM, categorizando a los pacientes en “buen pronóstico”, “pronóstico intermedio” y “pobre” pronóstico (17).
Grupo de buen pronóstico
-No-seminoma (56% de los casos): Sobrevida libre de enfermedad a 5 años 89%
Todos los criterios siguientes: • Primario testicular o RTP • Sin metástasis viscerales ni pulmonares • AFP < 1,000 ng/mL • hCG < 5,000 IU/L (1,000 ng/mL) • LDH < 1.5 x ULN
-Seminoma (90% de los casos): Sobrevida libre de enfermedad a 5 años 82%
Todos los criterios siguientes: • Cualquier sitio primario • Sin metástasis viscerales ni pulmonares • AFP normal • Cualquier hCG • Cualquier LDH
Grupo de pronóstico intermedio
-No-seminoma (28% de los casos): Sobrevida libre de enfermedad a 5 años 75%
Cualquiera de los siguientes criterios: • Primario testicular o RTP • Sin metástasis viscerales ni pulmonares • AFP 1,000 – 10,000 ng/mL o • hCG 5,000 – 50,000 IU/L o • LDH 1.5 – 10 x ULN
-Seminoma (10% de los casos): Sobrevida libre de enfermedad a 5 años 67%
Todos los criterios siguientes: • Cualquier sitio primario • Sin metástasis viscerales ni pulmonares • AFP normal • hCG cualquier valor • LDH cualquier valor
Grupo de pronóstico pobre
-No-seminoma (16% de los casos): Sobrevida libre de enfermedad a 5 años 41%
Cualquiera de los siguientes criterios: • Primario mediastinico • Metástasis visceral no pulmonar • AFP > 10,000 ng/mL o • hCG > 50,000 IU/L (10,000 ng/mL) o • LDH > 10 x ULN
-Seminoma Ningún paciente clasifica como de pobre pronóstico
Clasificación patológica
Los tumores del testículo constituyen un grupo de tumores diferentes desde el punto de vista morfológico y clínico, donde la gran mayoría de ellos corresponde a tumores de células germinales que se clasifican en seminomas y no-seminomas, a partir de diferencias en su tratamiento e historia natural. Cerca del 95% de los tumores aparecen en el testículo, pero 2-5% son extragonadales, principalmente localizados en el mediastino y/o RTP.
Los tumores seminomas constituyen el 52-56%, mientras los no-seminomas el 44-48%, donde se incluye el carcinoma embrionario, tumor del saco vitelino (o Yolk sac), teratoma y coriocarcinoma. Los tumores no-seminomas pueden encontrarse en forma pura o asociados entre ellos, llamados tumores mixtos, con o sin componente seminomatoso. La mayoría de los tumores se encuentran en forma mixta.
Los tumores de células no germinales del testículo son raros, e incluyen a los tumores del estroma testicular, tumores del tejido linfático o hematopoyético, tumores de la rete-testis y tumores de los anexos testiculares.
La clasificación anatomo-patológica recomendada (modificada de la versión de 2016 de la Guía de la Organización Mundial de la Salud (OMS) es (18):
1. Tumores de células germinales
• Neoplasia in situ de células germinativas (CIS).
2. Derivados de Neoplasia de Células Germinales in situ
• Seminoma
• Carcinoma embrionario.
• Tumor del saco vitelino (Yolk sac) postpuberal
• Tumores trofoblásticos.
• Teratoma, tipo postpuberal.
• Teratoma con diferenciación somática.
• Teratoma con diferenciación somática.
• Tumores mixtos de células germinales.
3. Tumores de Células Germinales no relacionados a Neoplasias in situ
• Tumor espermatocítico
• Tumor saco vitelino, pre-puberal
• Tumor mixto de células germinales, tipo pre-puberal
4. Tumores de los cordones sexuales/estroma gonadal
• Tumor de células de Leydig
• Tumor maligno de células de Leydig
• Tumor de células de Sertoli
• Tumor maligno de células de Sertoli
• Tumor de células de Sertoli con células grandes calcificadas
• Neoplasia de células de Sertoli con células intratubulares grandes hialinizadas
• Tumor de células de la granulosa
• Tipo adulto
• Tipo juvenil
• Grupo de tumores del tecoma/fibroma
• Otros tumores de los cordones sexuales/estroma gonadal
• Incompletamente diferenciado
• Mixto
• Tumores que contienen células germinativas y cordones sexuales/estroma gonadal (gonadoblastoma)
5. Tumores diversos del estroma inespecífico
• Tumores epiteliales del ovario.
• Tumores de los conductos colectores y la rete-testis.
• Adenoma
• Carcinoma
• Tumor de las estructuras paratesticulares
• Tumor adenomatoide
• Mesotelioma (Epiteloídeo, Bifásico)
• Tumores del Epidídimo
• Cistoadenoma del Epidídimo
• Cistoadenoma papilar
• Adenocarcinoma del epidídimo
• Tumores mesenquimáticos del cordón espermático y anexos testiculares
Neoplasia intratubular o CIS: a excepción del seminoma espermatocítico, todos los cánceres de células germinales del adulto se originan de un CIS. Consiste en células germinales indiferenciadas con apariencia de seminoma, localizadas basalmente dentro del túbulo seminífero, el que presenta espermatogénesis reducida o ausente, reemplazando los componentes normales del túbulo seminífero. La presencia de un tumor in situ en la pieza de orquiectomía no tiene implicancias pronósticas.
Seminoma: es el tipo más común. Se presentan generalmente a edades mayores que los tumores no-seminoma, la mayoría de los casos diagnosticados entre los 40-50 años. Se trata de una masa blanquecina multilocular de superficie lisa. La presencia de necrosis es rara y habitualmente focal. Son células de núcleo poligonal y citoplasma claro en distribución laminar, divididas en nidos celulares por septos fibro-vasculares que contienen linfocitos. Pueden encontrarse también sincitio-trofoblastos en el 15% de los tumores, lo que se relaciona clínicamente con el aumento de ß-HCG. Histológicamente se pueden confundir con las formas sólidas de carcinoma embrionario, tumores de saco vitelino o tumores de células de Sertoli. Los tumores seminomas son negativos para tinción con CD30, positivos para CD117 y fuertemente positivos para fosfatasa alcalina placentaria (PLAP).
Seminoma espermatocítico: es una forma rara que representa el 1% de los cánceres de células germinales. Se caracteriza por no originarse en una neoplasia intraepitelial, no se asocia a antecedente de criptorquidia o bilateralidad, no expresa PLAP y no forma parte de tumores testiculares mixtos. Es un tumor benigno que aparece con mayor frecuencia en la 6ta. década de la vida y que se cura con orquiectomía exclusiva.
Carcinoma embrionario: consiste en células malignas indiferenciadas semejantes a células epiteliales primitivas embrionarias con marcado pleomorfismo nuclear. Su apariencia microscópica es variable, con crecimiento de patrón sólido, papilar, alvéolo glandular o tubular. Es el tipo celular más indiferenciado de los cánceres de células germinales no-seminoma, totipotencial para diferenciarse a otro tumor de células germinales, en el sitio primario o en el sitio de metástasis. Pueden existir células sincicio-trofoblásticas. Macroscópicamente es un tumor café-amarillento con extensas áreas de necrosis y hemorragia que tiñe para AE1/AE3, PLAP y OCT3/4 y no tiñe para c-KIT. El carcinoma embrionario es un tumor agresivo con altos índices de metástasis, generalmente con marcadores tumorales normales.
Coriocarcinoma: es un tumor raro pero muy agresivo, generalmente se presenta con ß-HCG muy elevada y enfermedad diseminada al momento del diagnóstico. Su diseminación es hematógena, generalmente a pulmón, cerebro e hígado, pero se han reportado metástasis a sitios inhabituales como ojo y piel. Microscópicamente se compone de sincitio-trofoblastos y cito-trofoblastos, con tinción positiva para ß-HCG y áreas prominentes de hemorragia y necrosis.
Tumor de saco vitelino o Yolk sac: representa una fracción menor de los tumores germinales del adulto, pero es frecuente en tumores pediátricos y del mediastino. Los cánceres mixtos tienen habitualmente elementos de Yolk sac, que consiste en una red reticular de células cuboides de tamaño mediano con glóbulos eosinofílicos e hialinos intra y extra citoplasmáticos. Dichos glóbulos son característicos y representan sobre el 84% de los casos. Los tumores del saco vitelino crecen en un patrón glandular, papilar o microcístico. Poseen cuerpos de Schiller-Duval que simulan senos endodermales. Casi siempre produce AFP, pero no HCG.
Teratoma: son tumores que contienen elementos bien o incompletamente diferenciados de al menos dos de las tres capas de células germinales: endodermo, mesodermo y ectodermo, mezclados dentro del tumor. Los tumores bien diferenciados son llamados teratomas maduros, mientras los incompletamente diferenciados, es decir, con elementos similares al tejido fetal o embrionario, se denominan teratomas inmaduros. Macroscópicamente son habitualmente sólido-quísticos y clínicamente se presentan con marcadores tumorales normales, aunque puede existir una elevación leve de AFP. Pueden crecer en forma incontrolable, invadiendo estructuras adyacentes y hacerse irresecables. Raramente pueden transformarse en tumores malignos tales como rabdomiosarcoma, adenocarcinoma o tumores primitivos del neuroectodermo. Aproximadamente 47% de los tumores mixtos tienen teratoma, pero un teratoma puro es inhabitual. En el adulto corresponde a un tumor histológicamente benigno, pero se encuentra generalmente presente en cánceres no-seminoma en etapas avanzadas. Se cree que las formas no-seminoma tienen la habilidad de madurar a teratoma. A pesar de su apariencia histológica benigna pueden presentar anomalías genéticas frecuentemente presentes en tumores germinales malignos: aneuploidía, i(12p) y capacidad proliferativa amplia variable. Su fluido contiene frecuentemente AFP y HCG, confirmando su potencial maligno. Es resistente a QMT y se encuentra en 40-50% de las masas residuales postQMT.
Cáncer extragonadal: 2-5% de los cánceres de células germinales son de ubicación extragonadal y se desarrollan en ubicaciones anatómicas de la línea media (mediastino, RTP o glándula pineal). Esto se debería a migración errada de células germinales desde el borde genital durante el desarrollo o por migración reversa desde el testículo a localizaciones extragonadales. La localización extragonadal más frecuente es mediastínica. A diferencia de los tumores gonadales y RTP extragonadales, los tumores no- seminoma extragonadales en mediastino son menos sensibles a QMT y tienen un peor pronóstico de sobrevida a 5 años. Al contrario, los seminomas mediastínicos tienen pronóstico similar a los seminomas testiculares. Los tumores extragonadales RTP son indistinguibles biológicamente de los testiculares y tienen igual pronóstico.
Marcadores tumorales
Los tumores testiculares son una de las pocas enfermedades neoplásicas que tienen marcadores tumorales de utilidad (β-HCG, APF y LDH), un hecho fundamental en el diagnóstico, tratamiento, pronóstico y seguimiento de estos pacientes.
En los pacientes sospechosos de presentar un tumor testicular se deben medir marcadores tumorales pre-orquiectomía, para ayudar al diagnóstico e interpretación de sus niveles postcirugía. Para propósitos de etapificación, es importante conocer los valores 5-7 días post-orquiectomía y su velocidad de declinación. Los niveles normales no descartan la presencia de un tumor testicular. En algunos casos de enfermedad avanzada al momento del diagnóstico, la sola presencia de marcadores tumorales elevados puede ser suficiente para hacer el diagnóstico e iniciar tratamiento.
Sub-unidad Beta de Gonadotrofina Coriónica humana (B-HCG)
Es el marcador que con más frecuencia se eleva en pacientes con cáncer testicular. Es producida por células del trofoblasto. Al momento del diagnóstico, la β-HCG está elevada en el 20-40% de los cánceres no-seminoma en etapas iniciales y en 40-60% cuando se diagnostica tardíamente. El carcinoma embrionario y el coriocarcinoma secretan β-HCG. Aproximadamente el 15% de los seminoma secreta β-HCG, pero niveles sobre 1000UI/l se asocian habitualmente con tumores no-seminoma; valores sobre 5.000 UI/l obligan a descartar metástasis cerebrales con RM. Su vida media es de 24-36 horas y puede elevarse también en pacientes con cáncer hepático, de vía biliar, páncreas, estómago, pulmón, mama, riñón y vejiga. Pueden existir falsos positivos en hipogonadismo, hipertiroidismo y consumidores de marihuana, pero los valores no superan los 20 UI/l en estos casos. Por lo tanto, de deben repetir frente a la sospecha de valores falsamente positivos por ausencia radiológica de enfermedad.
Alfa fetoproteína (AFP)
Producida por células del saco vitelino. Al momento del diagnóstico, la AFP está elevada en el 50-70% de los pacientes con etapas iniciales de cáncer de células germinales no-seminoma y en el 60-80% de estos pacientes en etapas avanzadas. El carcinoma embrionario y los tumores del saco vitelino secretan AFP, mientras que el coriocarcinoma y el seminoma no producen AFP. Por eso, en presencia de un tumor testicular histológicamente catalogado de seminoma pero con AFP elevada, se considerará como un tumor no-seminoma. La vida media de AFP son 5-7 días. Puede elevarse también en pacientes con carcinoma hepatocelular, cáncer de estómago, páncreas, conductos biliares y pulmón, así como en enfermedades hepáticas benignas (infecciosas, inducidas por alcohol o drogas, autoinmune), telangectasia atáxica y tirosinemia.
Deshidrogenasa láctica (LDH)
Se encuentra elevada en el 20% de los pacientes con cáncer de células germinales en etapas iniciales y en el 20-60% de los pacientes en etapas avanzadas. De sus 5 isoenzimas, LDH-1 es la que se eleva en los tumores de células germinales. LDH se expresa también en el músculo liso, cardíaco y esquelético. Pacientes portadores de linfoma pueden presentar niveles elevados de LDH. Su vida media es de 24 horas y es un buen marcador de pronóstico de la enfermedad al diagnóstico, ya que la magnitud de su elevación se correlaciona con la extensión de la enfermedad.
Existen varios marcadores tumorales alternativos novedosos y potencialmente útiles clínicamente. Estos incluyen NSE, TRA-1-60, PLAP, AFP reactivo con lectina y ADN circulante libre de células. Estos marcadores aún están en evaluación y requieren más investigación para establecer su utilidad en el cáncer testicular a futuro (19).
Tratamiento de la enfermedad localizada
Tumores de células germinales etapa i
El tratamiento luego de orquiectomía radical depende de la histología del tumor, de su etapa al diagnóstico y de los factores de riesgo asociados. En la actualidad existen 4 formas de tratamiento adyuvante: Vigilancia Activa (VA), Linfadenectomía Lumbo-aórtica (LALA), Radioterapia (RDT) y QMT sistémica, las que pueden utilizarse solas o combinadas, como parte del manejo multimodal de la enfermedad. La decisión debe tomarse en conjunto con el paciente considerando sus ventajas y desventajas, así como la situación particular de cada paciente.
Seminoma
Aproximadamente el 80% de los tumores seminomas diagnosticados se encuentran en esta etapa, con sobrevida específica cercana al 99%, independiente de la terapia empleada inicialmente.
1. Vigilancia Activa
El uso de VA ha ayudado a minimizar los efectos a largo plazo de las terapias adyuvantes y representa el manejo de elección en la mayoría de las guías clínicas para cáncer testicular.
Sólo el 15% de los pacientes en etapa I tienen enfermedad metastásica sub-clínica al momento del diagnóstico y progresarán durante VA, la mayoría en los ganglios infra-diafragmáticos; es decir, el 85% de los pacientes se curan luego de orquiectomía y no requieren tratamiento adyuvante. Tamaño tumoral > 4 cms. e invasión de la rete-testis se han propuesto como factores de riesgo de recaída; en ausencia de ellos, la recurrencia sería 6%. Aproximadamente el 99% de las recaídas se curan con RDT y/o QMT. La tasa de sobrevida específica por cáncer en centros con experiencia es de 97- 100%.
Más del 90% de las recaídas ocurren en el RTP, durante los primeros 3 años de seguimiento, y son detectadas mediante TAC en la mayoría de los casos. La falta de adherencia a VA no ha demostrado reducir la sobrevida global en esta etapa.
2. Quimioterapia adyuvante
Un ciclo de carboplatino posterior a orquiectomía reduce el riesgo de recaída a 1.8-8.6% y se acepta como alternativa a VA. El estudio conjunto (MRC TE19) de Medical Research Council (MRC) y European Organisation for Research and Treatment Cancer (EORTC) comparó un ciclo de carboplatino con RDT adyuvante demostrando no inferioridad de QMT adyuvante respecto a tasas de recurrencia y sobrevida a 4 años. Dos ciclos de carboplatino pueden reducir recaídas a 1-3%. Las recaídas son usualmente en el RTP por lo que su evaluación radiológica es mandatoria. Las recaídas pueden ser tratadas con RDT, QMT con cisplatino o resección de la masa si es pequeña, pero no todos los pacientes serán curados. No se conoce el efecto a largo plazo de terapias con cisplatino.
3. Radioterapia adyuvante
El seminoma es extremadamente sensible a RDT. Aplicada a un campo para-aórtico o en “palo de hockey” (ganglios para-aórticos e ilíacos ipsilaterales) con dosis de 20-24 Gy, reduce la tasa de recaída al 1-3%. Después de la RDT moderna, casi todas las recaídas ocurren fuera de los campos irradiados (ganglios supradiafragmáticos o en pulmón). Un estudio randomizado demostró que una dosis de radiación de 20 Gy era similar a una de 30 Gy con una menor tasa de complicaciones: recuento de espermios más alto a 18 meses, efectos gastrointestinales crónicos sólo en 5% y toxicidad aguda moderada en 60%. Sin embargo, RDT adyuvante no se recomienda en la actualidad por el alto riesgo de una segunda neoplasia no-germinal a largo plazo: a 22 años el riesgo es 53% dentro del campo irradiado, resultando en una disminución de la sobrevida específica por cáncer de 46%.
Tratamiento adaptado al riesgo
El uso de factores de riesgo de recaída para decidir manejo es controversial. Se han propuesto el tamaño tumoral > 4cm y la invasión del rete testis como factores de riesgo para enfermedad RTP no detectada al diagnóstico. Empleando dichos factores, el riesgo de recaída durante VA será 32% en pacientes con ambos factores de riesgo y 6-15% a 5 años ausencia de ellos. La sugerencia es VA en pacientes de bajo riesgo y QMT con carboplatino aquellos de alto riesgo, siendo aparentemente preferibles 2 ciclos ya que disminuyen el riesgo de recaída a 1.5% a 30 meses vs 5% luego de 1 ciclo.
No seminoma
Sólo 20% de los tumores testiculares no-seminomas se encuentran en esta etapa al momento del diagnóstico. La mayoría se cura sólo con orquiectomía radical. Alrededor del 30% tiene compromiso RTP sub-clínico y recaerá. El principal predictor de recaída es la presencia de invasión linfovascular vascular (LVI) en o cerca del tumor primario en la biopsia, aunque también la presencia de carcinoma embrionario puro parece serlo. LVI tiene un valor predictivo negativo del 77%, permitiendo VA en pacientes de bajo riesgo. Los pacientes de bajo riesgo (etapa IA) constituyen el 50-70% de los cánceres en etapa clínica I y tienen sólo 15-20% de riesgo de recaída, comparado con un 50% de recaída en pacientes de alto riesgo (etapa IB)
1. Vigilancia activa
Aproximadamente 30% de los pacientes con cáncer no-seminoma etapa clínica I tienen metástasis subclínicas y recaerán con VA exclusiva luego de orquiectomía. El 80% de las recaídas ocurren durante el primer año de seguimiento, 12% durante el segundo año y 6% durante el tercer año, disminuyendo al 1% durante el cuarto y quinto año; ocasionalmente pueden ser más tardías. Alrededor del 35% de los pacientes con recaída tienen marcadores tumorales normales al momento de la recurrencia y cerca del 60% de estas se presentan en el RTP. A pesar de VA estricta, el 11% tiene recurrencia con enfermedad de gran volumen. Las tasa de recurrencia comparando VA con LALA pueden deberse a que algunos pacientes, presumiblemente por riesgo, son excluidos de un programa de VA. Basado en los informes de sobrevida específica, puede ofrecerse VA en centros con experiencia a pacientes sin factores de riesgo, siempre que estén comprometidos e informados de las expectativas de recurrencia así como del tratamiento de rescate.
2. Quimioterapia adyuvante
Varios estudios han utilizado 2 ciclos de QMT con Cisplatino, Etopósido y Bleomicina (BEP) como tratamiento primario para pacientes de alto riesgo. Estas series con más de 200 pacientes, algunas con un seguimiento medio de 8 años, tienen sólo 2.7% de recaídas, con muy escasa toxicidad a largo plazo. 2 ciclos de QMT no parecen afectar adversamente la fertilidad y la actividad sexual. Sin embargo, no se conocen los efectos secundarios a muy largo plazo (> 20 años), especialmente cardiovasculares.
Esquemas adyuvantes de 1 ciclo de BEP tienen resultados similares, demostrándose recaídas a 5 años de 3.2% en pacientes de alto riesgo vs 1.6% en pacientes de bajo riego. Más del 90% de las recaídas son prevenibles con QMT adyuvante, y todas ocurren antes de los 3 años luego del tratamiento. La reducción de 2 a 1 ciclo impacta significativamente el costo-beneficio de la QMT.
En Valdivia, desde el año 1990, tratamos a todos los pacientes con cáncer no-seminoma etapa clínica I, independiente de la presencia de factores de riesgo, con 1 ciclo de QMT adyuvante. Los primeros 30 pacientes recibieron vinblastina, bleomicina y cisplatino y observamos sólo 1 recidiva (0.8%); posteriormente, con esquema BEP hasta el año 2014 tenemos más de 120 pacientes tratados, sin recaídas (20).
3. Linfadenectomía lumboaórtica
Dado los altos índices de sobrevida específica para tumores no-seminomas en etapa I con VA/QMT en caso necesario, el rol de LALA primaria a disminuido significativamente. Al comparar 1 ciclo de QMT adyuvante vs LALA se observa un 7% de beneficio para QMT y un número menor de pacientes con recaídas, sin diferencias en calidad de vida entre ambos tratamientos.
Si se efectúa LALA, 18-30% tiene ganglios metastásicos RTP, lo que corresponde a una etapa patológica II. Si no se encuentran ganglios positivos, alrededor del 10% tendrá recurrencia a distancia. Un 30% de pacientes con LALA positiva (etapa patológica II) recae si sólo se vigilan después de la cirugía, principalmente en sitios fuera del abdomen y pelvis. El riesgo de recaída depende de la cantidad de enfermedad resecada. Por el contrario, si 2 ó más ciclos de QMT adyuvante basada en Cisplatino son administrados después de una LALA positiva, la recaída se reduce a menos del 2%.
La presencia de teratoma en el tumor primario no es una indicación específica de LALA, pero debe considerarse fuertemente dado la resistencia a QMT y recurrencia tardía de este tipo de tumor.
LALA por vía abierta o mínimamante invasiva es factible en manos experimentadas y debe ser recomendada sólo en centros especializados, dado los altos índices de recurrencia y complicaciones fuera de dichos centros. Debe ofrecerse a pacientes muy seleccionados, que no acepten VA y tengan contraindicación de QMT.
Tratamiento adaptado al riesgo
Una opción racional de manejo de estos pacientes es clasificarlos según su riesgo de recurrencia basado en la presencia de LVI en la biopsia del testículo. Diferentes estudios demuestran índices de sobrevida y curación cercanos al 100% con esta estrategia: VA para pacientes de bajo riesgo (etapa IA) y QMT adyuvante, preferentemente 1 ciclo de BEP, para aquellos de alto riesgo (etapa IB). En presencia de recaída se propone LALA si marcadores tumorales son negativos y 3 ciclos de BEP si son positivos.
Tratamiento de la enfermedad metastásica
El tratamiento del cáncer testicular metastásico depende de la histología del tumor primario y del grupo pronóstico al cual pertenece, definido por el International Germ Cell Cancer Collaborative Group (IGCCCG) (21).
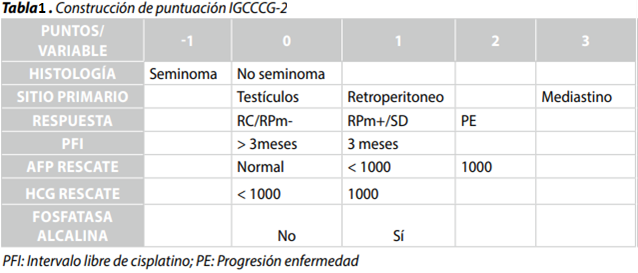
El score pronóstico del IGCCCG-2 comprende 7 de los factores más importantes (histología: seminoma vs no seminoma, sitio del tumor primario, respuesta a la QMT inicial, duración del intervalo libre de progresión, nivel de AFP al rescate, nivel de HCG al rescate y la presencia al rescate de metástasis hepática, ósea o cerebral). Usando estos factores, 5 grupos de riesgo (muy bajo riesgo = -1 punto; bajo riesgo = 0 puntos; riesgo intermedio = 1-2 puntos; riesgo alto = 3-4 puntos; muy alto riesgo > 5 puntos) fueron identificados con diferencias significativas de sobrevida libre de progresión y sobrevida global (Tablas 1 y 2).



Seminoma Etapa IIA/B
El tratamiento estándar ha sido la RDT con dosis de 30 y 36 Gy para las etapas IIA y IIB, respectivamente. El campo irradiado debe ser la región para-aórtica y el campo ilíaco ipsilateral, con margen de seguridad de 1-1.5 cms. Con esta técnica se logra una sobrevida libre de recurrencia de 90-92% para las etapas IIA y IIB. La sobrevida global es casi del 100%. La reducción de la dosis a 27 Gy se asocia a un 11% de recaída. En la etapa IIB, la QMT con 3 ciclos de BEP o 4 ciclos de etopósido y cisplatino (EP), en caso de estar contraindicada la bleomicina, es una alternativa a la RDT. La toxicidad aguda es mayor en QMT y RDT se asocia a mayor toxicidad tardía. Ambos alcanzan un nivel similar de control de la enfermedad. Estudios en pacientes IIB demuestran 100% de sobrevida libre de recurrencia a 5.5 años. El carboplatino como agente único no es una alternativa.
No seminoma Etapa IIA/IIB
Hay consenso que el tratamiento debe comenzar con QMT en todos los casos avanzados de cáncer no-seminoma, excepto para la etapa IIA de teratoma puro sin marcadores tumorales elevados, la cual puede ser tratada ya sea con VA o LALA para clarificar la etapa. Si VA es aceptada, después de 6 semanas es necesario evaluar si la lesión permanece estable, está creciendo o está disminuyendo. Una lesión que disminuye puede ser de origen no maligno y debe observarse, mientras que una lesión estable o que crece indica teratoma o un tumor maligno indiferenciado. Si la lesión está creciendo sin alza de los marcadores tumorales debe efectuarse LALA. Si el crecimiento se acompaña de alza de los marcadores tumorales debe efectuarse QMT con 3 ciclos de BEP.
Una alternativa a la estrategia de VA en no seminoma etapa IIA es una biopsia guiada por TAC o ECO si técnicamente es posible. Pacientes que no desean QMT primaria tienen la opción de LALA primaria con conservación de nervios y, en caso de ganglios positivos, 2 ciclos de QMT adyuvante con BEP. QMT y LALA primaria son comparables en sus resultados pero los efectos colaterales y toxicidad son diferentes. La tasa de curación con cualquiera es de 98%.
En pacientes con etapa IIA/IIB con recaída en TAC y marcadores negativos, debe realizarse una biopsia guiada para confirmar la metástasis , ya que existen pocas publicaciones que respalden el PET SCAN en esta situación (22).
Enfermedad metastásica avanzada (IIC, III)
La indicación es QMT primaria.
Seminoma de buen pronóstico: Se recomiendan 3 ciclos de BEP. En caso de contraindicación de bleomicina, 4 ciclos de EP han demostrado curar casi todos estos casos (23).
Seminoma de pronóstico intermedio: Se recomiendan 4 ciclos de BEP. En caso de contraindicación de bleomicina, 4 ciclos de VIP (etopósido, cisplatino, ifosfamida).
No-seminoma de buen pronóstico: Se recomiendan 3 ciclos de BEP. En caso de contraindicación de bleomicina, 4 ciclos de EP. Hay que tener en cuenta que en los pacientes tratados con EP es significativamente mayor la posibilidad de encontrar tumor vivo en la resección de masas post QMT, comparados con los que reciben BEP (31.9% vs. 7.8%).
No-seminoma de pronóstico intermedio: Se recomiendan 4 ciclos de BEP. La adición de paclitaxel (T-BEP) no mejora los resultados pero aumenta la toxicidad, por lo que no debiera plantearse inicialmente como tratamiento.
No-seminoma de pobre pronóstico: Se recomiendan 4 ciclos de BEP. 4 ciclos de cisplatino, etopósido, ifosfamida (PEI), no agrega mejores resultados, siendo más mielotóxico.
La sobrevida a 5 años es de alrededor del 50%. El grupo de pacientes con pobre respuesta en sus marcadores tumorales luego del ciclo 1 ó 2 de BEP tiene un pronóstico más pobre. Se recomienda aumentar las dosis y hacer más intensiva la QMT, aunque está por demostrarse si mejora la sobrevida (24).
También se benefician con QMT más intensiva los pacientes con tumores no-seminomas primarios mediastínicos y los pacientes con metástasis cerebrales al momento del diagnóstico.
No hay indicación para aplicación profiláctica de factor estimulante de colonias de granulocitos (G-CSF). Sin embargo, si una complicación infecciosa ocurre durante la QMT, la administración profiláctica de G-CSF se recomienda para los siguientes ciclos.
No hay recomendaciones generales para modificación del tratamiento para pacientes con mala condición general (Karnofsky < 50%) o extensa infiltración hepática (> 50%). Pacientes con extensa infiltración pulmonar están en riesgo de un síndrome agudo de distress respiratorio; adaptando la dosis del régimen BEP en el primer ciclo (sólo 3 días de EP sin bleomicina) disminuiría el riesgo de muerte precoz.
Re-Etapificación
La re-etapificación se efectúa por imágenes y por la evaluación de los marcadores tumorales. Luego de la disminución del marcador, la estabilización o regresión del tumor, se debe completar la QMT (3 ó 4 ciclos dependiendo de la etapa inicial). En el caso de disminución de los marcadores pero de crecimiento de las metástasis, la resección del tumor es obligatoria después de finalizada la inducción. Sólo con un aumento documentado del marcador después de 2 ciclos de QMT está indicado un cambio precoz de la terapia. Generalmente estos pacientes son candidatos a estudios con nuevas drogas. Pacientes con un bajo nivel de HCG postratamiento con un “plateau” del marcador deben ser observados para ver si ocurre un completa normalización; pacientes con un bajo “plateau” de AFP después de la QMT deben efectuarse una resección de masas residuales con monitoreo de la AFP post-cirugía. QMT de rescate está indicada sólo ante alzas documentadas de los marcadores.
Resección de tumor residual
Seminoma
La masa residual de un seminoma no debe ser resecada primariamente, independiente del tamaño, pero debe ser controlada con imágenes y marcadores tumorales.
El PET de Fluoro-deoxiglucosa (FDG-PET) tiene un alto valor predictivo negativo en estos pacientes. Para reducir los falsos positivos se recomienda realizar este examen por lo menos 2 meses después de la QMT. En pacientes con masa residual > 3 cm, FDG-PET debe efectuarse para obtener información de la viabilidad de estas masas. En pacientes con masas residuales < 3 cm, el uso de FDG-PET es opcional.
En el caso de masa residual post QMT que aún es positiva en el FDG-PET sin aumento de tamaño, debe repetirse el estudio a las 6 semanas. Una conducta alternativa es realizar una biopsia de la masa. Si en este nuevo estudio la masa persiste vital o progresa, debe realizarse tratamiento de rescate, ya sea QMT o RDT.
Una publicación reciente describe un bajo valor predictivo positivo para tumor residual > 3 cms en seminoma post QMT (11-38%, dependiendo de los subgrupos) por lo que se recomienda precaución cuando se toman conductas solo en base al PET (25).
Los pacientes con masas persistentes o con progresión post QMT inicial, quienes tienen HCG elevada, deben ir a terapia de rescate inmediatamente. Los pacientes que progresan sin HCG elevada, deben someterse a biopsia mínimamente invasiva o cirugía abierta, antes de indicar tratamiento de rescate. LALA raramente está indicada y debe realizarse en centros de referencia por la dificultad de la cirugía.
No-seminoma
Posterior a QMT de primera línea con BEP puede quedar tumor viable en el 6-10% de los casos; en 50% de estos casos hay teratoma maduro y en 40% fibrosis. El FDG-PET no está indicada en la re-etapificación post QMT.
En los pacientes con remisión completa, sin masa evidente, no está indicada la resección tumoral. La tasa de recaída a largo plazo en este grupo de pacientes es de 6-9%, pero un tercio de estos pacientes no sobrevivirán. La resección es mandataria en pacientes con masas residuales de >1 cm. En pacientes con lesiones < 1 cm aún existe el riesgo de cáncer residual o teratoma, aunque es discutible el papel de la cirugía en este contexto.
En enfermedad RTP persistente de gran volumen, todas las áreas de los sitios metastásicos primarios deben ser resecadas 4-6 semanas después de completar QMT. Existe creciente evidencia que las resecciones “limitadas” en pacientes seleccionados proporcionan resultados equivalentes a largo plazo, comparada con una resección bilateral sistemática en todos los pacientes.
Cuando hay múltiples masas residuales, debe comenzarse la resección por la masa de mayor volumen. La histología puede ser diferente en los diferentes órganos. Si una masa RTP contiene sólo fibronecrosis, existe un 90% de probabilidad de que las masas pulmonares tengan igual histología. La resección de las lesiones pulmonares contralaterales no es obligatoria en caso que el examen histológico de las lesiones del primer pulmón muestre necrosis completa.
Calidad de la cirugía
La cirugía post-QMT es exigente y con frecuencia requiere intervenciones vasculares agregadas, como prótesis de vena cava o aorta. Por lo tanto, los pacientes deben ser referidos a un centro especializado con cirugía interdisciplinaria (resecciones hepáticas, reemplazo vascular, neurocirugía de columna, cirugía torácica). Los pacientes en tales centros se benefician de una reducción de la mortalidad perioperatoria de 6 a 0.8%. Los urólogos especializados son capaces de reducir la tasa de recurrencia local de 16% a 3%, con una tasa más alta de resecciones completas.
Cirugía de salvataje y desperation surgery
La cirugía de salvataje sigue siendo una opción curativa en los pacientes con masas residuales resecables post QMT de salvataje. Desperation surgery se refiere a la resección de enfermedad que no responde o progresa ante la QMT de rescate. Cuando la enfermedad es resecable, una proporción significativa permanece libre de enfermedad a largo tiempo (26).
QMT de consolidación después de una cirugía secundaria
Después de resección de necrosis o un teratoma maduro/inmaduro, no se requiere un tratamiento posterior. En el caso de una resección incompleta de un tumor viable, 2 ciclos de QMT adyuvante convencional en base a cisplatino pueden ser administrados en ciertos subgrupos (pacientes de “mal pronóstico”).
Después de resección completa de un tumor activo en menos del 10% del volumen total, especialmente en pacientes de “buen pronóstico” inicial, la tasa de recaída es muy baja y la QMT adyuvante no es beneficiosa para prevenir recaídas posteriores. El pronóstico definitivamente empeorará si la neoplasia maligna es encontrada después de la QMT de segunda línea y de tercera línea. En este último caso, la QMT postoperatoria no está indicada y es incapaz de mejorar el pronóstico.
Tratamiento de rescate sistémico para recaída o enfermedad refractaria
QMT de rescate en una combinación en base a cisplatino, logrará remisiones a largo plazo de alrededor del 50% en los pacientes que recayeron después de QMT de primera línea. Los esquemas de elección son: 4 ciclos de PEI/VIP (Etopósido, Ifosfamida, Cisplatino), 4 ciclos de TIP (Paclitaxel, Ifosfamida, Cisplatino) o 4 ciclos de VlP (Vinblastina, Ifosfamida, Cisplatino).
Aún no es posible determinar si QMT de combinación en base a cisplatino en dosis convencionales es suficiente como primer tratamiento de rescate o si una intensificación precoz del tratamiento de primera línea de rescate con QMT de altas dosis debiera intentarse. QMT de rescate en dosis convencional puede alcanzar remisiones a largo plazo entre 15-40% de los pacientes, dependiendo de los factores de riesgo individuales.
La terapia de rescate con VelP no es superior a otros esquemas de tratamiento de combinación de dosis convencionales en base a cisplatino. Paclitaxel y gemcitabina han probado ser activas en el tratamiento del tumor refractario. Ambas drogas son de acción sinérgica con cisplatino. Dependiendo de la presencia de factores pronósticos adversos, los resultados de la terapia de rescate después de un tratamiento de primera línea en base a cisplatino son insatisfactorios.
Algunos estudios han mostrado una mejoría de un 10% en la sobrevida con intensificación precoz del primer tratamiento de rescate usando altas dosis de QMT.
QMT de altas dosis no ofrece ventajas como primer tratamiento de rescate en pacientes de buen pronóstico, en comparación a las dosis convencionales. Sin embargo, varios estudios fase II han mostrado una mejoría en la sobrevida de pacientes de mal pronósticos usando terapia en altas dosis en el primer tratamiento de rescate.
Segunda recaída
No hay estudios, pero las terapias convencionales no parecen tener buenos resultados. Si han recibido QMT de primera y una de rescate con dosis convencionales, debieran recibir QMT en altas dosis con apoyo de stem cells autólogas. Estos pacientes tienen 20- 25% de posibilidades de cura.
Se consideran refractarios a cisplatino aquellos pacientes que recaen 4-8 semanas después de QMT basada en cisplatino, los que progresan durante la QMT o los que progresan rápidamente luego de un régimen de QMT en altas dosis. En estos pacientes, la combinación de gemcitabina y oxalipatino o la triple combinación de éstos más paclitaxel, han logrado respuestas entre el 25-45%. Los pacientes que responden y van a una resección de mesa residual pueden lograr cura en un 15-20%.
Recaída tardía
La recaída tardía se define como cualquier evento que se presente después de 2 años de una terapia para un cáncer testicular metastásico, con o sin resección de masa residual. Esto ocurre en 1,4% de los seminoma y 3,2% de los no-seminoma. Si es posible, toda lesión en paciente con un no-seminoma debe resecarse, independientemente del nivel de sus marcadores tumorales, para resecar completamente todo tumor indiferenciado de células germinales, teratoma maduro o un cáncer secundario de células no-germinales.
Pacientes con alza rápida de HCG pueden ser una excepción a la cirugía inmediata y pueden beneficiarse de una inducción con QMT de rescate antes de la cirugía. Si las lesiones son resecadas incompletamente, la terapia de rescate debiera iniciarse de acuerdo a la histología de las lesiones. Si el paciente responde a QMT de rescate, una cirugía secundaria debería efectuarse si es posible. En el caso de enfermedad refractaria localizada, irresecable, puede considerarse RDT. Para evitar el exceso de morbi-mortalidad, las recaídas tardías deberían tratarse en un centro con experiencia.
Tratamiento de las metástasis cerebrales
Las metástasis cerebrales pueden verse al momento del diagnóstico o en el marco de una recaída sistémica y raramente como una recaída aislada. La sobrevida a largo plazo de pacientes presentando metástasis cerebral al inicio del diagnóstico es mala (30-40%), pero aún peor es el desarrollo de una metástasis cerebral como una enfermedad recurrente (la tasa de sobrevida a 5 años es de 2-5%). QMT es el tratamiento inicial en este caso y algunos datos apoyan el uso de RDT de consolidación, aún en el caso de respuesta completa a la QMT. La cirugía debe ser considerada en el caso de una metástasis solitaria persistente dependiendo del estado sistémico de la enfermedad, la histología del tumor primario y la localización de la metástasis.
Seguimiento
El objetivo del seguimiento durante los primeros años es realizar el diagnóstico precoz de la recurrencia, para así ofrecer el tratamiento curativo menos agresivo posible. Para conseguir esto, el seguimiento de tumores de células germinales se basa en parámetros clínicos (anamnesis y examen físico), de laboratorio (marcadores tumorales) e imagenológicos:
- TAC de abdomen y pelvis
- TAC de tórax: si bien es cierto tiene mayor valor predictivo que la Rx de tórax, su uso se reserva para escenarios específicos
- Rx de tórax
- RM de abdomen: es una alternativa a la TAC en centros con experiencia. Actualmente el estudio TRISST (27) está evaluando la RM como alternativa a la TAC en el seguimiento de los tumores seminomas etapa I
- Ecografía testicular: solo indicada frente a la sospecha clínica de tumor contralateral
- PET/CT FDG: de acuerdo a las Guías Europeas y de la NCCN, su uso está reservado para las masas residuales > 3 cms. post QMT en tumores seminomas, con el objetivo de definir la presencia de tumor viable. Se debe considerar su realización al menos 6 semanas post QMT para evitar falsos positivos.
En la mayor parte de los tratamientos curativos, las recidivas se producirán dentro de los dos primeros años por lo que en este período el seguimiento es crucial. Las recidivas tardías > 5 años son eventos raros que ocurren en cerca de 0,5% de los casos. El objetivo de los seguimientos prolongados es la detección de los efectos tardíos del tratamiento, fundamentalmente la aparición de neoplasias secundarias a RDT o QMT.
En los casos en que se realizó LALA, la recidiva en RTP es rara, siendo más frecuente en el tórax. En algunos casos, dependiendo del volumen de la enfermedad, la presencia de recidiva en los bordes quirúrgicos también es factible.
En relación a la imagenología, TAC de tórax presenta mayor valor predictivo que Rx de tórax; sin embargo, no está indicada en todos los casos. En los casos de tumores no-seminomas y seminomas etapa I en VA, el rol de la imagenología de tórax no está claro, ya que la recurrencia aislada en tórax sin enfermedad retroperitoneal es rara.
Los resultados del tratamiento dependen del volumen de la enfermedad, por lo tanto un enfoque intensivo parece ser justificable para detectar enfermedad asintomática.
En los últimos años la forma de enfocar esta etapa del manejo ha cambiado, variando la frecuencia de los controles y la duración del seguimiento. De esta forma, los programas de seguimiento deben adecuarse a cada paciente en particular, tomando en cuenta el tipo de paciente, riesgo de recurrencia y tipo de tratamiento inicial.
De acuerdo a la guías de la Asociación Europea de Urología 2019 existen tres grandes grupos de pacientes, los que se confeccionan en base a riesgo de recidiva y tratamiento recibido:
- Pacientes con tumores seminomas Etapa I
- Pacientes con tumores no-seminomas Etapa I en VA
- Todos los pacientes que recibieron tratamiento adyuvante o QMT curativa para enfermedad metastásica de pronóstico bueno e intermedio, logrando remisión completa con o sin cirugía (en tumores seminomas incluye masas residuales de menos de 3 cm o más de 3 cm con PET negativo)
Los pacientes que no logren remisión completa o se presenten en la categoría de mal pronóstico representan un grupo aparte.
En base a lo anterior, las guías de la Asociación Europea de Urología confeccionaron las sugerencias de seguimiento post tratamiento (Tablas 3,4 y 5) (28):






Por su parte, la NCCN sugiere protocolos de seguimiento que varían en la frecuencia de los exámenes pero que en general se basan en los mismos conceptos teóricos. La estrategia seguimiento dependerá de la modalidad de tratamiento utilizada y de la etapa tumoral (29).
Tumores seminomas en etapa I
70-80% de pacientes con tumores seminomas presentan una enfermedad en etapa clínica I al momento del diagnóstico; 15%‐20% tiene masa RTP en la TAC y sólo 5% presenta diseminación a distancia al diagnóstico. En el caso de los tumores etapa I, la recidiva posterior a orquiectomía varía 1-20% dependiendo del tratamiento elegido.
Debido a su extrema radio y quimiosensibilidad, las tasas de curación en estos casos son elevadas, llegando prácticamente al 100%.
30% de los seminomas presenta elevación de HCG al momento del diagnóstico o durante su evolución, siendo este método poco fiable para el seguimiento.
La imagenología de tórax se solicita sólo si está clínicamente indicada dado que la recurrencia se diagnostica por TAC o, menos frecuentemente, por elevación de los marcadores tumorales.
Seguimiento durante VA (tabla 6)
El riesgo de recidiva fluctúa 6-20% a 5 años, siendo frecuentemente entre 12-18 meses; esto no aumenta la mortalidad. En 30% de los casos hay recidivas aún más tardías.
Las recidivas más frecuentes son en linfáticos para-aórticos (82%), aunque ganglios pélvicos, inguinales y pulmones también pueden verse afectados. La recurrencia aislada en el tórax es extremadamente rara por lo que en general la imagenología de tórax no es indispensable en los protocolos del seminoma etapa I, salvo pacientes sintomáticos o según criterio médico. Sin embargo se sugiere realizar una Rx de tórax en conjunto con TAC de abdomen y pelvis.
El seguimiento en estos casos debe ser estricto durante al menos 5 años, considerando la alta tasa de recidiva.


Seguimiento posterior a RDT (tabla 7)
RDT logra una sobrevida global de 99% a 5-10 años. La tasa de recidiva es de 1-5%, habitualmente dentro de los primeros 18 meses. Los sitios de recidiva más frecuentes son los ganglios supradiafragmáticos, el mediastino y pulmones. Se han descrito recidivas tardías, lo que debe considerarse al momento de fijar los plazos del seguimiento después del quinto año.
Seguimiento posterior a QMT adyuvante (tabla 7)
1 ó 2 ciclos de QMT basada en cisplatino tienen tasas de recidiva de 2-4%. Las recurrencias son principalmente en el RTP.


Tumores no-seminomas en etapa I
Aproximadamente 5 % de los pacientes con tumores no-seminomas etapa I presenta concentraciones elevadas de marcadores tumorales tras la orquiectomía y 25%-30% tendrá recidivas durante los 2 primeros años.
El calendario de seguimiento variará dependiendo de la estrategia de tratamiento elegida de entre estas tres alternativas:
– Vigilancia Activa
– LALA (con conservación nerviosa)
– QMT adyuvante.
Seguimiento durante VA (tablas 8 y 9)
Los resultados de VA dependen de una etapificación preoperatoria adecuada y de un buen programa de seguimiento. Con VA se producirán recidivas entre 20-30% de los casos; 80 % durante los 12 meses siguientes a orquiectomía y 12% durante los 12 meses siguientes.
La mediana del tiempo hasta la recidiva es de 6 meses, Sin embargo, pueden surgir recidivas al cabo de 3-5 años, y aún más tardías (4%/año). La recidiva se produce principalmente en el RTP (20%) y en segundo lugar en mediastino y pulmones (10%).
La estrategia de seguimiento varía levemente dependiendo de la presencia de factores de riesgo: LVI, compromiso del cordón o del escroto. Sin embargo, VA sería más apropiada en los pacientes sin factores de riesgo.
El uso de los marcadores tumorales es de suma importancia, dada su elevación frente a las recurrencias. TAC de abdomen y pelvis tiene un rol relevante sobre todo frente a la presencia de teratoma, donde los marcadores son negativos. En general, las recurrencias se diagnosticarán por la elevación de los marcadores o la aparición de lesiones en la TAC.


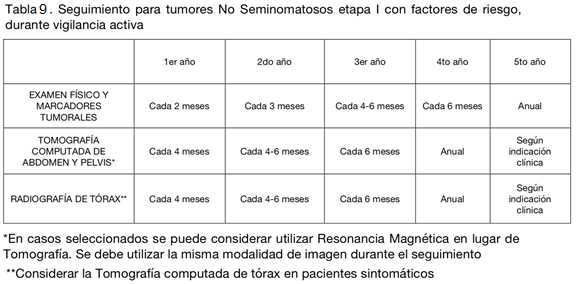

Existe información limitada sobre la estrategia óptima de seguimiento, por lo que estas son solo recomendaciones. Aún así, el esquema óptimo puede modificarse de acuerdo al riesgo de recidiva del tumor, tomando en cuenta que la importancia de las TAC adicionales al segundo año es dudosa.
Seguimiento después de LALA con conservación nerviosa. (tabla 10)
En estos casos, si la técnica quirúrgica fue adecuada y en un centro especializado, la recidiva RTP es rara, por lo que se elimina la necesidad de TAC abdominales repetidas.
Las recidivas pulmonares se observan en 10-20% de los pacientes, presentándose en 90% los 24 meses siguientes a linfadenectomía.
Seguimiento posterior a QMT adyuvante (tabla 10)
La recurrencia luego de 1 ciclo de QMT adyuvante es 1-3 %, dependiendo de la existencia o no de factores de riesgo.
Aún no está clara la necesidad de la evaluación repetida y a largo plazo del RTP. Sin embargo, debido al riesgo de presentar un teratoma tardío de crecimiento lento en elRTP luego de QMT, se debe realizar al menos una TAC anual por 2 años.


Los controles posteriores al 5to. año, tanto en frecuencia como en duración, se deben realizar de acuerdo al criterio clínico, tomando en cuenta las características de pacientes, del tumor y el tratamiento realizado.
Seguimiento en enfermedad etapa II y III en tumores seminomas y no-seminomas
En el caso de seminoma etapa IIB con enfermedad voluminosa, la NCCN sugiere el uso de QMT como tratamiento adyuvante, mientras que en la enfermedad no voluminosa IIB y en etapa IIA, QMT y RDT. Además, en los casos de la enfermedad no voluminosa, las recurrencias son poco frecuentes y ocurren generalmente dentro de los 3 primeros años. Esto determina variaciones en la frecuencia del seguimiento (tablas 11 y 12).




En los tumores avanzados, la extensión de la enfermedad se correlaciona con la respuesta al tratamiento y la sobrevida. La combinación de QMT basada en cisplatino y cirugía logra tasas de curación entre 65-85%, dependiendo de la extensión inicial de la enfermedad. Las tasas de respuestas completas a QMT son de 50%- 60%. Entre 20-30% de los pacientes podría quedar sin enfermedad con la cirugía posterior a QMT (tabla 13).


A mayor etapa de enfermedad, mayor riesgo de recidiva. De esta forma, el volumen del tumor primario determina la evolución de la enfermedad en pacientes con tumores no-seminomas. En no-seminoma etapa II, independientemente del tratamiento adoptado, se logran tasas de sobrevida del 97%, siempre que la recidiva se identifique tempranamente. En el caso de tumores no-seminomas etapa II sometidos a LALA primaria, con tumor viable en la anatomía patológica (pN2-3), la recurrencia es superior al 50%. Sin embargo, se reduce a menos del 1% posterior a 2 ó 3 ciclos de BEP. En este mismo escenario, si la anatomía patológica es negativa (pN0), la vigilancia es una alternativa ya que la cirugía se considera curativa (tablas 14 y 15).




En relación a la masa residual post QMT en tumores seminomas, el tamaño es fundamental para definir el manejo, ya que entre 30-50% de masas > 3 cm tienen tumor viable en su interior versus 0-9% de masas < 3 cm. Es aquí donde el PET/CT tienen su mayor utilidad, dado que en el caso de ser negativo, permite regímenes de seguimiento menos intensos.
Finalmente, los principales motivos de fracaso de tratamiento en tumores no-seminomas avanzados se pueden mencionar la presencia de enfermedad voluminosa que no responde totalmente a QMT, la presencia de teratoma residual irresecable posterior a QMT y la presencia o desarrollo de elementos no germinativos quimio-resistentes (8,2%). Estos elementos se deben considerar al momento del seguimiento.
Toxicidad a largo plazo posterior a tratamiento curativo del cáncer de testículo
Durante el seguimiento, además de la recurrencia, los pacientes deben ser evaluados para pesquisar la aparición de efectos tóxicos del tratamiento, en especial las neoplasias secundarias.
El riesgo de una neoplasia secundaria sólida es mayor en la medida que los pacientes hayan recibió RDT o QMT en edades más tempranas. Este riesgo se mantiene elevado al menos por 35 años. Las neoplasias secundarias a RDT se localizan principalmente en relación al campo irradiado y, en algunos casos, se relacionan directamente con la dosis usada. QMT por otro lado, aumenta el riesgo de desarrollar tanto neoplasias sólidas como hematológicas, con una incidencia acumulativa a 10 años de 1,4% y 4,2% respectivamente.
Los eventos a considerar son principalmente:
- Leucemia (3 veces más que la población normal)
- Infecciones
- Complicaciones pulmonares
- Toxicidad cardiovascular
- Fenómeno Raynaud –like
- Neuro-toxicidad
- Deterioro de la función cognitiva
- Oto-toxicidad
- Nefro-toxicidad
- Hipogonadismo
- Fatiga
- Calidad de vida
Bibliografía
- The Global Cancer Observatory, March, 2019. https://gco.iarc.fr/today/data/factsheets/cancers/28-Testis-fact-sheet.pdf
- Goldberg H, Klaassen Z, Chandrasekar T,Fleschner N, Hamilton R, Jewett M. Germ Cell Testicular Tumors-Contemporary Diagnosis, Staging and Management of Localized and Advanced disease. Urology 125:8-19, 2018
- Chia VM, Quraishi SM, Devesa SS, Purdue MP, Cook MB, McGlynn KA. International
- Trends International Trends in the Incidence of Testicular Cancer, 1973-2002. Cancer Epidemiol Biomarkers Prev. 2010;19(5):1151–9.
- https://diprece.minsal.cl/auge/acceso-guias-clinicas/guias-clinicas-desarrolladas-utilizando-manual-metodologico/cancer-de-testiculos-en-personas-de-15-anos-y-mas/descripcion-y-epidemiologia/
- Gorena M, Cifuentes M,González R,Villagrán J,Hinostroza JA,Pastor P,Rivera P,Venegas P, Orellana JJ. Perfil clínico y epidemiológico del cáncer testicular en la IX Región. Rev Ch Urol. 2003; 68(1):78-82
- Riveri R,Cornejo H,Kramm J,Díaz L. 10 años de cáncer de testículo en la provincia de Ñuble (1995-2004). Rev Ch Urol. 2006; 71(3):205-208
- Serie defunciones y mortalidad observada por tumores malignos edad y sexo. Departamento de Estadísticas e Información de Salud. Ministerio de Salud. 2017.
- DeSantis CE,Lin CC,Mariotto AB,et al. Cancer treatment and survivorship statistics,2014 CA Cancer J Clin. 2014;64:252-271
- Lutke Holzik, M.F., et al. Genetic predisposition to testicular germ-cell tumours. Lancet Oncol, 2004. 5: 363
- Lip, S.Z., et al. A meta-analysis of the risk of boys with isolated cryptorchidism developing testicular cancer in later life. Arch Dis Child, 2013. 98: 20.
- Greene, M.H., et al. Familial testicular germ cell tumors in adults: 2010 summary of genetic risk factors and clinical phenotype. Endocr Relat Cancer, 2010. 17: R109
- Peng, X., et al. The association risk of male subfertility and testicular cancer: a systematic review. PLoS One, 2009. 4: e5591.
- Heidenreich A, Weissbach L, Holth W, Albers P, et al. German Testicular Cancer Study Group. Organ soaring surgery for malignant germ cell tumour of the testis. J Urol.2001 Dec;166(6):2161-5
- de Wit, M., et al. [18F]-FDG-PET in clinical stage I/II non-seminomatous germ cell tumours: results of the German multicentre trial. Ann Oncol, 2008. 19: 1619.
- Huddart, R.A., et al. 18fluorodeoxyglucose positron emission tomography in the prediction of relapse in patients with high-risk, clinical stage I nonseminomatous germ cell tumors: preliminary report of MRC Trial TE22–the NCRI Testis Tumour Clinical Study Group. J Clin Oncol, 2007. 25: 3090.
- Brierley, J.E., et al., The TNM Classification of Malignant Tumours 8th edition. 2018. http://www.uicc.org/resources/tnm/publications-resources
- Mead, G.M., et al. The International Germ Cell Consensus Classification: a new prognostic factor-based staging classification for metastatic germ cell tumours. Clin Oncol (R Coll Radiol), 1997. 9: 207. https://www.ncbi.nlm.nih.gov/pubmed/9315391
- Williamson, SR, Delahunt, B, Magi-Galluzzi, C, Algaba, F, Egevad, L.,Ulbright, et al. The WHO 2016 Classification of Testicular Germ Cell Tumours: a Review and Update from the ISUP Testis Consultation Panel.Histopathology. 2017Feb;70(3):335-346
Milose J, Filson C, Weizer A, Hafez K, Montgomery J. Role of biochemical markers in testicular cancer:diagnosis,staging, and surveillance.Open Access J Urol. 2012; 4: 1–8
- Ebel L. Ciclo único de quimioterapia adyuvante en cáncer testicular no seminoma etapa I. Rev Ch Urol 2007;72(3):221-229
- Mead, G.M., et al. The International Germ Cell Consensus Classification: a new prognostic factorbased staging classification for metastatic germ cell tumours. Clin Oncol (R Coll Radiol), 1997. 9: 207
- de Wit, M., et al. [18F]-FDG-PET in clinical stage I/II non-seminomatous germ cell tumours: results of the German multicentre trial. Ann Oncol, 2008. 19: 1619.
- Thibault, C., et al. Compliance with guidelines and correlation with outcome in patients with advanced germ-cell tumours. Eur J Cancer, 2014. 50: 1284.
- Oldenburg, J., et al. Testicular seminoma and non-seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013. 24 Suppl 6: vi125.
- Cathomas, R., et al. Questioning the Value of Fluorodeoxyglucose Positron Emission Tomography for Residual Lesions After Chemotherapy for Metastatic Seminoma: Results of an International Global Germ Cell Cancer Group Registry. J Clin Oncol, 2018. 36: 3381.
- Beck, S.D., et al. Outcome analysis for patients with elevated serum tumor markers at postchemotherapy retroperitoneal lymph node dissection. J Clin Oncol,2005. 23: 6149.
- Joffe J, Huddart R, Williams M, Rowles N,et al. Trial of Imaging and Schedule in Seminoma Testis (TRISST). https://www.ctu.mrc.ac.uk/media/1302/trisst-protocol.pdf
- EAU Guidelines on Testicular Cancer 2019, https://uroweb.org/guideline/testicular-cancer/
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Testicular Cancer, NCCN Evidence Blocks™ Version 1.2019 –October 31, 2018.
