Capítulo 26
Cáncer de próstata
- Dr. Ignacio San Francisco Reyes, Dr. Pablo Troncoso Carrasco
- Dr. Alvaro Zúñiga Avendaño, Dr Tomás Merino Lara
- Hospital Clínico UC. Red de Salud UC- CHRISTUS
- Pontificia Universidad Católica
Epidemiología
El cáncer de próstata (CaP) representa el tumor maligno más frecuente, después del cáncer cutáneo, en hombres adultos a nivel mundial, y se estima que durante el año 2018 fueron diagnosticados aproximadamente 1.3 millones de casos nuevos 1. La incidencia de de CaP en los países con un índice sociodemográfico medio-bajo es menor que en los países desarrollados 2. En los Estados Unidos, el CaP es el cáncer con mayor incidencia y se estima que se diagnosticaron 164,690 nuevos casos durante el año 2018 3. En cuanto a mortalidad, el CaP es la quinta causa más común de muerte por cáncer en todo el mundo con estimación de 358,989 muertes durante el año 2018 4. En los Estados Unidos, el CaP es la segunda causa de muerte por cáncer y se estima que se produjeron 29,430 muertes debido a este cáncer durante el año 2018 3. A diferencia de las tasas de incidencia, la tasa de mortalidad en regiones más desarrolladas es menor que en las regiones menos desarrolladas. Varios países desarrollados han reducido la tasa de mortalidad por CaP durante los últimos años al implementar políticas nacionales de salud que han incrementado el diagnóstico temprano de la enfermedad 5.
En Chile, el CaP es el cáncer más frecuente en hombres adultos 6,7. Si bien, los registros nacionales de los valores de incidencia de esta patología son solo parciales, se estima que durante el año 2018 se registraron 6576 nuevos casos de CaP con una tasa de incidencia ajustada de 51,2 por 100 mil hombres utilizando los datos de tres registros poblacionales de cáncer de las regiones de Antofagasta, Los Ríos y la Provincia del Bio Bio 8. Actualmente, esta patología es la segunda causa de muerte por cáncer en hombres y se estima que en el año 2018 fue responsable de 2270 muertes, con una tasa de mortalidad ajustada de 15.8 por cien mil hombres 1,8-10. En Chile, la mortalidad por CaP ha aumentado progresivamente en los últimos años, con tasas no ajustadas de 15 por 100 mil hombres en 1997; 17,4 por 100 mil hombres el año 2002 y más de 23 por 100 mil hombres el año 2012. Sin embargo, al ajustar las tasas por edad, estos valores muestran una tendencia estable entre los años 2000 y 2012. Si bien, el aumento en la tasa de mortalidad por CaP en Chile se ha logrado estabilizar en los últimos años, es importante tener en consideración que los índices de mortalidad son altos respecto a otros países 9. Si analizamos las tasas de mortalidad por CaP en Chile, este valor se encuentra entre los más altos de los países latinoamericanos y de los pertenecientes a la Organización para la Cooperación y el Desarrollo Económico (OCDE) 1,11. Teniendo en consideración estas estadísticas, Chile debiese implementar políticas que permitan disminuir los altos índices de mortalidad por CaP.
El riesgo de desarrollar un CaP durante la vida es aproximadamente 1 en 6 (16%), sin embargo el riesgo de morir por la enfermedad es aproximadamente de un 2% 12. Esta discrepancia entre la incidencia y letalidad del CaP ha condicionado mucho de la controversia en el manejo de los pacientes, particularmente de aquellos con enfermedad de bajo riesgo. Desafortunadamente los parámetros clínicos que actualmente se utilizan para discriminar entre una enfermedad agresiva y las formas llamadas “indolentes” son limitados en una proporción importante de pacientes.
Etiología y Factores de Riesgo
Edad: Es el factor de riesgo más importante. Muy raramente ocurre antes de los 45 años. Según las estadísticas del programa SEER 12, del National Cancer Institute de Estados Unidos, en el período 2000-2004 no se diagnosticaron cánceres de próstata bajo los 34 años de edad; 0.5% entre los 35 y 44 años; 8.4% entre 45 y 54; 27.3% entre 55 y 64; 36.7% entre 65 y 74; 22.4% entre 75 y 84; y 4.7% por encima de los 85 años. Podemos suponer que en nuestro país, con el envejecimiento de su población, este problema será cada vez de mayor prevalencia.
Factores genéticos: La historia familiar de cáncer prostático implica un aumento en el riesgo de padecer la enfermedad. Un familiar de primer grado aumenta al doble el riesgo y; dos o más familiares, lo hacen entre 5 y 11 veces. Las mutaciones BRCA1 y BRCA2 aumentan el riesgo de padecer cáncer prostático. BRCA 1 aumenta el riesgo en menores de 65 años y BRCA 2 se asocia a Gleason elevado y a peor pronóstico.
Raza: En EEUU se ha visto que es más frecuente en hombres de raza negra, luego caucásicos y es menos prevalente e asiáticos. Los afroamericanos tienen más riesgo de enfermedad avanzada y agresiva, aun ajustando variables socioeconómicas y clínicas.
Dieta: El elevado consumo de grasa de origen animal y carnes rojas contribuiría en el desarrollo de cáncer prostático.
Hormonales: No se ha demostrado que altos niveles séricos de andrógenos se relacionen con mayor riesgo de CaP. La obesidad y niveles elevados de IGF-1 aumentarían levemente el riesgo.
Tabaquismo: sólo se ha demostrado aumento de riesgo en grandes fumadores.
Síndrome metabólico: El síndrome metabólico está constituido por una serie de alteraciones en los lípidos circulantes los valores de glicemia, hipertensión y obesidad que aumentan el riesgo individual de enfermedad cardiovascular y diabetes y es la consecuencia de un exceso de ingesta calórica y un estilo de vida sedentario.
La presencia de síndrome metabólico se ha asociado a un mayor riesgo para el desarrollo de numerosos cánceres. Una gran mayoría de estas asociaciones sin embargo, son pequeñas y pueden ser diferentes en poblaciones diferentes En los últimos años se ha acumulado evidencia que relaciona también a este síndrome con el riesgo de desarrollar cáncer prostático. Se han postulado varios mecanismos mediante los cuales estas alteraciones metabólicas participarían en el desarrollo del cáncer. La vía más explorada es la del factor de crecimiento tipo insulina (IGF-1) que está constituida por los factores de crecimiento IGF-1, IGF-2, una serie de proteínas de unión (IGFBP) y el receptor del IGF-1. La insulina es capaz de activar este receptor, el cual a su vez activa las vías del crecimiento celular e inhibe la apoptosis, ambos importantes mecanismos involucrados en la carcinogénesis. El desarrollo de hiperinsulinemia asociado a los fenómenos de resistencia a la insulina en el síndrome metabólico pude afectar la estimulación de estas vías de crecimiento celular. Los pacientes obesos tienen además niveles reducidos de adiponectina una hormona producida en el tejido adiposo, que participa en la homeostasis de la glucosa y el metabolismo lipídico y que presenta propiedades antiinflamatorias y antiagiogénicas. Se ha postulado también que los pacientes con síndrome metabólico pueden mantener niveles elevados de factor de crecimiento endotelial vascular (VEGF) uno de los promotores de la neovascularización tumoral. Por otro lado, los vasos peritumorales sobreexpresan el receptor de la insulina el cual adicionalmente también puede estimular la angiogénesis independiente de los factores de crecimiento endotelial.
Los pacientes con síndrome metabólico están en un estado de “inflamatorio crónico” con niveles de IL-6 elevados los cuales contribuyen a su vez a la resistencia a la insulina. Las citoquinas antinflamatorias como la IL-10 por su parte se encuentran disminuidas 13.
Todos estos factores pueden estar acentuados por los cambios relacionados con el envejecimiento. Sin embargo, la asociación del síndrome metabólico con el riesgo de CaP es débil y varía con la población estudiada. Entre los componentes individuales del síndrome (índice de masa corporal, alteraciones de la glicemia o dislipidemia, riglicéridos elevados, colesterol HDL bajo), solamente la hipertensión y la circunferencia de cintura> 102 cm se asocian con un riesgo significativamente mayor de CaP, en un 15% y 56%, respectivamente. Actualmente, no hay datos que sugieran que la intervención médica de estos factores reduciría efectivamente la progresión de CaP 14.
Receptor de Andrógenos: El receptor de Andrógenos (RA), pertenece a la superfamilia de receptores de acción nuclear y es activado por testosterona y dehidrotestosterona en el citoplasma y traslocado al núcleo como un factor de transcripción donde se une a una secuencia específica del DNA conocida como elemento de respuesta hormonal o respuesta androgénica. El RA interactúa también con otras proteínas nucleares lo que le permite estimular o inhibir la transcripción génica específica. La estimulación de la transcripción produce un aumento de la síntesis de RNA mensajero que es traducido a nivel ribosomal para producir proteínas específicas relacionadas con el crecimiento y diferenciación celular. Una de las secuencias génicas de activación del RA es el receptor del factor de crecimiento tipo insulina (IGF-1R) que revisamos en la sección de síndrome metabólico y su asociación con la progresión del cáncer. La señal andrógeno-RA juega un papel fundamental en el desarrollo y homeostasis normal de la próstata y ha sido involucrada también en la patogénesis y progresión del CaP.
Desde los trabajos pioneros de Huggins y Hodges, hace más de 70 años, se conoce que la terapia de deprivación andrógenica en las etapas avanzadas del del CaP permite suprimir su progresión durante 12 a 24 meses. Sin embargo, después de este periodo eventualmente el cáncer progresará a una etapa de resistencia, descrita como resistente a la castración. Esta progresión está asociada a una reactivación de la señal del RA y el uso de tratamientos alternativos de reciente desarrollo que bloquean esta señal, como la abiraterona o la enzalutamida que permiten una respuesta adicional en algunos casos, aunque en el corto plazo nuevamente se desarrolla resistencia con progresión de la enfermedad otra vez asociada a reactivación de la señal del RA 15.
Además de su contribución a la progresión de la enfermedad esta señal es crítica en la patogénesis del CaP. La evidencia experimental ha mostrado que la ausencia de exposición androgénica prolongada parece proteger contra el desarrollo del CaP, pero no ha sido posible establecer una relación dosis respuesta entre los niveles de andrógenos y el riesgo de CaP. Por otra parte el polimorfismo en los genes que codifican el RA y varias enzimas relacionadas al metabolismo androgénico pueden ser determinantes importantes el riesgo 16.
Anatomia patologica
Más del 95% de los casos de CaP son adenocarcinomas. El 5% restante corresponde a otros tipos histológicos, que pueden ser de origen epitelial (células mucinosas, en anillo de sello y células transicionales) y de origen no epitelial (carcinosarcoma, leiomiosarcoma, rabdomiosarcoma, linfoma maligno).
El adenocarcinoma se origina, generalmente, en la zona periférica. Deriva de los acinos glandulares (carcinoma acinar) y no más del 3% lo hace de los conductos glandulares (carcinoma ductal). En el 75-85% de los casos es un carcinoma multifocal y solo en menos del 10% es uninodular.
La identificación de un adenocarcinoma prostático puede ser limitada en las muestras obtenidas por biopsia por punción. Como veremos más adelante la inmunohistoquímica o los marcadores moleculares pueden ayudar al diagnóstico en los casos complejos. El diagnóstico histológico está basado en una serie de características citológicas y de la arquitectura glandular/estromal. La estructura se identifica por la presencia de glándulas pequeñas con nucléolos prominentes, típicamente más pequeñas que las glándulas benignas y con un patrón de crecimiento infiltrativo y desordenado, mucho más marcado aún en tumores menos diferenciados.
La diferenciación del cáncer se ha relacionado directamente con la probabilidad de metástasis y muerte, y la arquitectura tumoral se ha clasificado con el sistema histológico descrito por Gleason. Se le asigna un puntaje a la muestra, que va de 1 a 5, según sea más o menos diferenciado. Luego se calcula el score de Gleason, eligiendo los dos tipos más frecuentes y se suman para obtener el patrón histológico, que va de 2 a 10. Se ha definido como bien diferenciados los score igual o inferior a 6, moderadamente diferenciado el score 7, y pobremente diferenciados los 8 a 10. Más adelante veremos la clasificación ISUP que busca facilitar, tanto para el médico como para el paciente, la interpretación de la clasificiación del score de Gleason.
La inmunohistoquímica con marcación del antígeno prostático específico se utiliza para confirmar en los casos dudosos, el origen epitelial prostático. No es una técnica que permita diferenciar malignidad de patología benigna en biopsia de próstata, ya que tanto células cancerosas como del epitelio normal expresan antígeno prostático específico. Este tipo de estudio presenta más utilidad en la confirmación diagnóstica de metástasis. En casos seleccionados se puede realizar tinción para citoqueratina de alto peso molecular que permite identificar las células basales glandulares, las cuales están presentes en el tejido benigno, pero ausentes en los casos de cáncer. También se pueden utilizar marcadores moleculares para sostener el diagnóstico histológico en los casos difíciles como el P504S que representa a la racemasa alfa-metilacil-CoA (AMACR) presente en la célula cancerosa o la proteína nuclear p53 presente en la célula basal prostática y, por lo tanto, ausente en el tejido neoplásico. Otra serie de marcadores tisulares pueden utilizarse tanto en el diagnóstico de lesiones cancerosas, como en tejido con potencial maligno y los revisaremos en otra sección más adelante.
Carcinoma de células pequeñas o neuroendocrino: Las células neuroendocrinas están habitualmente presentes en los ductos y acinos prostáticos. La variante histológica de esta estirpe celular como tumor primario es bastante rara, 1 a 2% del total de cánceres prostáticos, es muy agresiva y fatal. Generalmente se presenta asociado con el adenocarcinoma típico. La presentación histológica es idéntica al Adenocarcinoma de células pequeñas del pulmón y es importante diferenciarlo del carcinoma con diferenciación focal neuroendocrina, ya que los carcinomas puros de células pequeñas son resistentes a la terapia hormonal utilizada en el Adenocarcinoma prostático. La diferenciación neuroendocrina puede ser confirmada con marcadores inmunohistoquímicos como la cromogranina, sinaptofisina o la enolasa neuronal específica. Este tipo de diferenciación en forma focal es bastante común en particular en los carcinomas de alto grado y su contribución pronostica es controvertida. En algunos estudios la presencia de diferenciación neuroendocrina focal se ha asociado a un peor pronóstico y en otros no se ha demostrado esta asociación. Actualmente no hay evidencia suficiente para recomendar tratar este tipo de tumores de una manera diferente al carcinoma clásico.
Carcinoma urotelial prostático: Como variante primaria, sin compromiso de la vejiga, esta modalidad es bastante rara. La mayoría corresponde a extensión de cáncer vesical que se extiende directamente a la uretra prostática o ductos prostáticos. En todo caso la presentación histológica es similar y el diagnóstico de origen está basado en la evaluación clínica. La presencia de invasión estromal prostática está asociada a un pronóstico peor y el tratamiento de esta presentación habitualmente sigue las recomendaciones de tratamiento del cáncer urotelial de vejiga.
Componentes importantes del informe histopatológico
El análisis histológico de cáncer prostático en un espécimen de biopsia no es siempre fácil, pero es esperable que el informe incluya un diagnóstico certero sin términos equívocos como “sospechoso” o “probable” y debe considerar otras características imprescindibles para el clínico. Como hemos visto el informe debe considerar la presencia de variantes histológicas:
Score de Gleason: Debe contener los dos principales grados presentes en la muestra. Si solo está presente un grado u otro grado menor está presente en menos del 5% de la muestra es recomendable que se informe el grado más representativo dos veces (por ejemplo si solo está el grado 4 u otro grado menor esta mínimamente presente se informe Gleason 4+4). Si en los cilindros de las biopsias existen diferentes grados y estos cilindros están separados por localización de la muestra (o alguna otra modalidad de distribución), es recomendable que en el informe se asigne un score diferente a cada cilindro.
En otras ocasiones la muestra puede contener un pequeño componente de alto grado además de los dos patrones predominantes, el grado de este componente menor es referido como el grado terciario de Gleason. En estos casos la Sociedad Internacional de Patología Urológica ha recomendado que se informe el grado más preponderante junto con el de mayor grado. Por ejemplo si están presentes mayoritariamente los grados 3+4 y una pequeña representación del grado 5 se informe Gleason 3+5. Si los grados más representativos son 4+3 y una pequeña proporción de grado 5 se informe Gleason 4+5 17.
Lado y localización del tumor: Como se señala más adelante, la información de la localización es menos importante que la lateralidad y a menudo aunque no existe un consenso a este respecto se utiliza para la decisión de conservar o no una de las bandeletas (ver sección de biopsia prostática)
Volumen tumoral estimado: Es habitualmente referido en la biopsia como número de cilindros comprometidos y proporción de cáncer en cada cilindro. Esta información entrega al clínico junto con otros factores, elementos pronósticos importantes junto a otros factores para decidir un tratamiento. Por ejemplo el compromiso tumoral en la mayoría de los cilindros se interpreta como una extensión mucho mayor de la enfermedad a que si el compromiso está solo limitado a pocos o solo un cilindro.
Invasión perineural (PNI): La invasión perineural debe ser informada y su presencia en la biopsia por punción se ha asociado generalmente a la extensión extraprostática en el espécimen de la prostatectomía radical y una mayor probabilidad de recurrencia posterior a radioterapia 18. El hallazgo de PNI en el espécimen de la prostatectomía tiene un valor más limitado en el pronóstico clínico.
Extensión extraprostática o de vesículas seminales: Generalmente la extensión extraprostática se establece en la pieza quirúrgica de la prostatectomía radical aunque ocasionalmente se puede encontrar extensión en el tejido adiposo periprostático en muestras de biopsias por punción. La presencia de extensión fuera de la cápsula prostática constituye una enfermedad localmente avanzada (T3). El compromiso de vesículas seminales o ductos eyaculatorios también debe ser informado en la biopsia en particular si expresamente se han enviado muestras de esta zona.
Neoplasia prostática intraepitelial (PIN): PIN es una proliferación neoplásica de las células epiteliales que es confinada a los ductos o acinos prostáticos. En contraste al adenocarcinoma la arquitectura glandular del PIN es normal y las células basales están conservadas. Se reporta hasta en un 5 a 10% de las biopsias y su presencia se ha considerado habitualmente importante, en particular cuando se trata de la forma de alto grado. Sin embargo, el riesgo de un cáncer en una segunda biopsia es levemente superior a si el primer set solo ha informado histología benigna y cuando se ha encontrado un cáncer en una segunda biopsia este habitualmente es uno de bajo grado. Solamente se ha recomendado informar el PIN de alto grado ya que la presencia de lesiones de bajo grado no tendría significado clínico.
Recientemente se ha sugerido que la necesidad de rebiopsiar a pacientes con PIN de alto grado debe considerarse cuando existen otros elementos que hagan sospechar riesgo de cáncer (como los incluidos en las calculadoras de riesgo de cáncer). En particular, la necesidad de rebiopsiar a estos pacientes se ha recomendado ante la presencia de PIN de alto grado en sitios múltiples en la biopsia (≥ 3) que se ha asociado a un riesgo de cáncer en una nueva biopsia de ~ 30% , ó ante la presencia de glándulas atípicas adyacentes a una zona de PIN de alto grado, que una nueva biopsia se ha asociado a un riesgo de CaP de ~ 50% 14.
No se ha encontrado relación entre la presencia de PIN y el APE, por lo que si una biopsia muestra PIN en un paciente con valor elevado de APE es una indicación para considerar una nueva biopsia.
Proliferación de acinos pequeños atípicos (ASAP): Corresponde a focos de atipía glandular sospechosa de adenocarcinoma, pero que no es suficiente para hacer el diagnóstico histológico de cáncer prostático. A diferencia del PIN se ha señalado que existe un riesgo de 40 a 50% de un adenocarcinoma prostático en biopsias repetidas en pacientes con ASAP y la recomendación en la presencia de este informe patológico es rebiopsiar dentro de 3 a 6 meses después del diagnóstico inicial 14.
Clasificación TNM del cáncer de próstata
TNM
TX: tumor primario no puede ser evaluado.
T0: no hay evidencia de tumor primario.
T1: tumor clínicamente no aparente, no palpable ni visible mediante imágenes.
T1a: descubrimiento histológico incidental del tumor en 5% o menos del tejido resecado.
T1b: descubrimiento histológico incidental del tumor en más del 5% del tejido resecado.
T1c: tumor identificado por biopsia de aguja (por ejemplo, a causa de APE elevado).
T2: tumor confinado dentro de la próstata*.
T2a: el tumor afecta la mitad de un lóbulo o menos.
T2b: el tumor compromete más de la mitad de un lóbulo pero no ambos.
T2c: el tumor afecta ambos lóbulos.
T3: el tumor se extiende a través de la cápsula prostática**.
T3a: extensión extra capsular (unilateral o bilateral).
T3b: el tumor invade la(s) vesícula(s) seminal(es).
T4: el tumor está fijo o invade estructuras adyacentes distintas a las vesículas seminales: el cuello de la vejiga, el esfínter externo, el recto, los músculos elevadores y/o la pared de la pelvis.
* Nota: el tumor se encuentra en uno o ambos lóbulos mediante biopsia con aguja, pero que no es palpable o confiablemente visible por imágenes es clasificado como T1c.
** Nota: invasión al ápice prostático o a la cápsula prostática (pero no más allá) no está clasificada como T3, pero sí como T2.
NX: ganglios linfáticos regionales no pueden evaluarse.
N0: no existe metástasis ganglionar linfática regional.
N1: metástasis en ganglio linfático regional o ganglios.
MX: metástasis distante no puede ser evaluada.
MO: no hay metástasis distante.
M1: metástasis distante.
M1a: ganglio(s) linfático(s) no regional(es).
M1b: hueso(s).
M1c: otro(s) sitio(s).
Marcadores tumorales
Se ha señalado que el cáncer prostático es una enfermedad heterogénea desde el punto de vista clínico y biológico que se desarrolla en medio de una serie de cambios genéticos y epigenéticos. Esta característica hace que el desarrollo de marcadores biomoleculares sea una maniobra racional para identificar a los pacientes que se puedan beneficiar del estudio diagnóstico y diferentes modalidades de tratamiento. Desafortunadamente no contamos actualmente con un marcador perfecto y como revisaremos en esta sección existen varias estrategias en desarrollo.
De un modo descriptivo los biomarcadores en cáncer prostático pueden ser clasificados de acuerdo a su rol en cuatro categorías principales, aunque muchos de ellos pueden ser aplicados en más de una función:
- marcadores que ayudan a discriminar a quienes biopsiar (pe, APE, PHI, hK2 y PCA 3)
- marcadores que ayudan a discriminar a quienes re-biopsiar (pe, ConfirmMDx, Prostate core mitotic tests o PCMT)
- marcadores que ayudan a decidir a quienes ofrecer tratamiento (pe, GPS, Prolaris, Decipher)
- marcadores utilizados para evaluar la respuesta al tratamiento (pe, células tumorales circulantes)
Biomarcadores para decidir biopsia
Antígeno Prostático Específico (APE o PSA)
El Antígeno Prostático Específico (APE) ha sido usado ampliamente como biomarcador para detectar el cáncer prostático. Sin embargo, como revisaremos en los párrafos siguientes, los problemas de sensibilidad y especificidad asociados a este test hacen que esté lejos de ser un marcador perfecto. Esto ha motivado la investigación de nuevos marcadores séricos y urinarios que pueden complementar la utilidad del APE o en un futuro reemplazarlo.
El APE es una proteasa sérica producida por los tejidos benignos y malignos de la próstata. Circula en la sangre como una forma no compleja (libre o no unida) o compleja (unida). Existen numerosas causas que pueden elevar la concentración de APE en la sangre sin estar relacionadas al CaP. Entre estas se incluyen: Hiperplasia Benigna de la Próstata, instrumentalización de la vía urinaria, prostatitis, infarto prostático, biopsia y trauma de la próstata.
El APE fue aprobado en 1986 por la FDA, inicialmente para el monitoreo de pacientes en tratamiento por CaP y en 1994 para la detección precoz asociado al tacto rectal en hombres mayores de 50 años. En el curso del tiempo, sin embargo se ha utilizado en un amplio rango de edades y también en forma aislada y no solo en diagnóstico precoz, sino que además en diversos programas de screening. Esto ha llevado a que un número importante de hombres se les haya realizado el test y como consecuencia de esto una fracción significativa de ellos haya requerido biopsias prostáticas. Este uso y abuso de examen mostró rápidamente sus falencias y limitaciones.
El nivel de corte de 4 ng/mL fue propuesto en 1986 por la compañía Hibritech Incorporated basado en el estudio de una cohorte de pacientes sin historia de cáncer prostático. Este fue el primer test aprobado por la FDA y rápidamente este valor de corte se estableció como límite para la recomendación de una biopsia, aunque se reconoció que los valores más bajos no descartaban la presencia de una lesión neoplásica. Hoy se considera el riesgo de cáncer asociado a los valores de APE como un continuo pudiendo presentarse a cualquier valor del examen, pero con una mayor frecuencia en valores más altos.
Cuando se usa el valor de corte de 4 ng/mL la sensibilidad estimada del APE es de un 21% en la detección de cánceres de cualquier tipo de riesgo y de un 51% para detectar cánceres de alto grado (Gleason ≥8). Si se utiliza un nivel de corte de 3 ng/mL la sensibilidad es de un 32 y 68% respectivamente. Le especificidad estimada es de 91% y de 85% utilizando niveles de corte de 4 y 3 ng/mL respectivamente. El valor predictivo positivo (VPP) del examen ha sido caracterizado en numerosos estudios de screening. Para un valor de corte de 4 ng/mL el VPP es aproximadamente de un 30%. Esto significa que aproximadamente uno de cada tres hombres con un valor de APE > 4 ng/mL tendrá un cáncer prostático posible de detectar en una biopsia. Para valores de APE >10 ng/mL el VPP aumenta a un 42 hasta un 64%. El valor predictivo negativo global estimado para un valor de APE ≤ 4 ng/mL es de un 85%. Los estudios de screening también han mostrado que la capacidad de detección de cáncer y el VPP disminuye substancialmente con la medición del APE en forma regular.
Como hemos señalado anteriormente, el riesgo de cáncer es continuo para todos los valores de APE. Este concepto está bien graficado en la información obtenida de los estudios de prevención de cáncer donde las biopsias efectuadas en el seguimiento del grupo no tratado mostraron que hasta un 17% presentaban un cáncer prostático con niveles de corte de 1,1 ng/mL. De esta manera, la elección de un nivel de corte determinado requiere sopesar el nivel de sensibilidad y especificidad deseado. A un nivel de corte más bajo aumentaría la sensibilidad del examen, pero disminuiría la especificidad con un mayor número de falsos positivos, lo que significa que un mayor número de pacientes se efectuaría biopsias innecesarias 19. Aunque se han sugerido niveles de corte más bajos no hay evidencia que el diagnostico de cáncer prostático en niveles < a 4 ng/mL tenga algún efecto en el pronóstico de la enfermedad.
Otro problema lo constituyen los diferentes tipos de ensayos y fabricantes disponibles para determinar el APE. No todos los tests tienen la misma capacidad de detección y numerosos estudios han demostrado que existe una gran variabilidad entre ellos. Los valores de los ensayos calibrados por la metodología de Hibritech, por ejemplo, pueden llegar a ser hasta un 25% más alto que aquellos calibrados según las recomendaciones de la OMS. Adicionalmente la medición del APE presenta una variabilidad biológica intraindividual de hasta un 20%. Todas estas características biológicas y analíticas dificultan por supuesto la interpretación clínica de los valores del APE. Por este motivo, la recomendación general ante un valor de APE elevado es confirmarlo con un nuevo examen antes de someter al paciente a procedimientos invasivos.
Se ha propuesto diferentes estrategias para aumentar el rendimiento del APE. A continuación revisaremos algunas de ellas.
Índices de referencia ajuste por edad: Los niveles de APE van aumentando conforme aumenta la edad de los pacientes ya que aumenta la prevalencia de hiperplasia prostática benigna y el volumen prostático. Generalmente, cuando se utilizan se asimilan a los valores descritos en población norteamericana normal 20. Los valores para distintos rangos de edad están ampliamente descritos en la literatura y la mayoría son muy similares siendo algo más altos en la población afroamericana. El ajuste del valor de corte según la edad mejora la especificidad en la población de más edad ya que se aumenta el valor de corte, reduciendo así el número de biopsias innecesarias. Esto, sin embargo, significa necesariamente disminuir la sensibilidad del examen y, por lo tanto, la posibilidad de no diagnosticar una proporción significativa de cánceres.
En el análisis de un estudio retrospectivo, el uso de niveles de corte ajustados por edad se asociaría a un 47% menos de detección de neoplasias localizadas 21. En la población más joven por su parte, el ajuste de un nivel de corte más bajo mejora la sensibilidad, lo que permite aumentar la detección precoz, pero esta estrategia se asocia a un 45% de aumento en biopsia prostáticas negativas. La utilidad real de los valores de APE ajustados por edad es controvertida y no son recomendados actualmente por la FDA.
Velocidad del APE: Aunque es esperable que el nivel de APE vaya aumentando con la edad, se ha propuesto que la velocidad de este aumento podría aumentar la precisión del valor total del APE en el diagnóstico precoz del cáncer prostático. La primera recomendación de que una velocidad del APE ≥ 0,75 ng/mL al año podría asociarse a un mayor riesgo de cáncer prostático es bastante antigua y se derivó del estudio longitudinal de envejecimiento de Baltimore que estableció que este valor de velocidad era más específico en el diagnóstico de cáncer prostático que un nivel de corte de 4 ng/mL 22. Sin embargo, este valor de velocidad se calculó solo con 18 casos de cáncer prostático.
El análisis de las series clínicas más recientes, sugieren que la velocidad del APE anual como variable independiente agrega poca información predictiva al valor del APE total. En el estudio de Prevención del Cáncer de Próstata (PCPT), la velocidad del APE no aportó información predictiva importante al nivel total de APE, especialmente en valores de APE ≥ 4ng/mL. Una velocidad > 0,35 ng/mL anual se asoció a cáncer en pacientes con APE total < 4 ng/mL y un tacto rectal no sospechoso. Aunque si se hubiera usado solo la velocidad como valor de corte se habría incrementado substancialmente el número de biopsias innecesarias en este grupo 23. Una revisión sistemática reciente concluyó que existe poca evidencia que apoye el uso de la velocidad del APE en la toma de decisiones clínicas 24. Otra de las limitaciones del uso práctico de estas determinaciones seriadas de APE como lo hemos visto anteriormente es la variabilidad intraindividual y de los diferentes ensayos de medición del APE
Densidad del APE: Como el nivel de APE puede aumentar conforme aumenta el volumen prostático por células benignas (en HBP), esta herramienta correlaciona el tamaño de la próstata con el nivel de APE. El concepto de densidad está basado en la observación que el cáncer prostático se ha asociado a aproximadamente 10 veces más APE por volumen que el tejido prostático benigno. Existen varias formas de estimar el volumen de la próstata, utilizando alguna de las fórmulas descritas previamente. Para esto generalmente se utiliza el volumen determinado mediante la ecotomografía prostática transabdominal, aunque la precisión de esta estimación es baja. El uso de la ecografía transrectal o la resonancia magnética para la estimación del volumen es poco práctica en la evaluación clínica rutinaria.
El valor de corte de densidad habitualmente recomendado en la literatura ha sido de 0,15 ng/mL/cc, sin embargo, la capacidad de detección de este valor es solo de un 50% en el rango de APE de 4 a 10 ng/mL. La información de estudios prospectivos sugiere que el ajuste del nivel de corte de la densidad en relación al valor del APE total puede mejorar significativamente la sensibilidad de esta medición. Un estudio alemán encontró que para alcanzar una sensibilidad del 95% los niveles recomendados de valor de corte parra la densidad fueron 0,05, 0,1 y 0,19 para valores de APE de 2-4 ng/mL, 4-10 ng/mL y 10-20 ng/mL., respectivamente 25.
Fracción libre del APE: El APE está presente de manera conjugada (ligado a proteínas) y libre. El porcentaje de APE libre por sobre el total es un indicador que puede utilizarse para la sospecha de CaP. Los valores de corte dependerán de la población estudiada. Así, un porcentaje <10% se asocia más comúnmente a CaP, mientras que porcentajes altos >25% son asociados a histología benigna 26.
Otros marcadores utilizados para la decisión de biopsiar
Debido a las limitaciones del APE la investigación se ha centrado en el desarrollo de nuevos ensayos basados en el la familia de las kalicreinas a la cual pertenece también el APE. Uno de estos, ya lo hemos revisado y corresponde a la heterogénea variante libre del APE. En esta fracción se encuentra el subtipo pro APE (hK2) que puede ser detectado en concentraciones más elevadas en pacientes con cáncer prostático que en aquellos con patología benigna. En esta misma fracción se encuentra el APE intacto (iAPE) o forma no catalítica de una sola cadena.
Indice de Salud prostática (Prostate Health Index, PHI): se calcula con el pro APE un subtipo del APE total y la fracción libre mediante la siguiente fórmula: PHI = hK2 /APE libre x 0,5 x APE total. En un metanálisis reciente que incluyó ocho estudios y cerca de 3.000 pacientes este índice mostró ser superior a la fracción libre del APE en la detección de cáncer en una primera biopsia en hombres con APE total entre 2 y 10 ng/mL 27.Tanto el PHI como el hK2 han permitido discriminar a pacientes con cánceres de alto o bajo grado, con enfermedad confinada a la próstata o con extensión extraprostática 28. Este índice, sin embargo, no ha mostrado ser superior al uso de otros marcadores como el 4KRK y el PCA 3 que revisaremos más adelante.
Panel de kalicreinas: el panel de cuatro marcadores de kalicreinas en la sangre (4KRK) incluye la fracción libre del APE, el iAPE el APE total y el hK2. Estudios recientes utilizando esta combinación de marcadores han mostrado que es capaz de discriminar cánceres del alto y bajo grado, reduciendo el número de biopsias innecesarias y aumentado la detección precoz de cánceres de alto riesgo. Se ha sugerido que este panel podría ser útil para seleccionar pacientes para vigilancia activa 29.
PCA3: es un RNA no codificante específico del tejido prostático que está sobre expresado en el CaP. Ensayos actuales cuantifican la sobre expresión de PCA3 en muestras de orina después del tacto rectal. PCA3 parece útil en predecir los resultados de biopsias tanto en biopsias iniciales como repetidas. Sin embargo, parece más útil para determinar qué pacientes deberían someterse a una segunda o tercera biopsia. La FDA ha aprobado el ensayo de PCA3 para ayudar a decidir, junto con otros factores, si es que es necesario repetir la biopsia en hombres de 50 años o mayores con una o más biopsias de próstata anteriores negativas.
Biomarcadores utilizados para decidir a quién re-biopsiar
Hemos visto que aún un porcentaje significativo de pacientes representan falsos negativos del estudio con biopsia prostática en quienes el cáncer no fue detectado en una primera serie. Por otra parte el examen de biopsia por punción no esta exento de riesgos y complicaciones. La decisión de re-biopsia continúa asociada mayormente a la cinética del APE posterior al examen y en algunos casos a hallazgos histológicos de riesgo de cáncer en la primera biopsia. En está área parece necesario la ayuda de exámenes que permitan al clínico decidir a quién re-biopsiar. Hemos mencionado anteriormente al PCA3. Revisaremos en esta sección algunos tests en desarrollo.
ConfirmMDx: Es un test epigenético que permitiría identificar aquellos pacientes verdaderos negativos en una primera biopsia de aquellos que puedan tener un cáncer oculto. Se basa en el efecto de campo epigenético o halo de “cancerización” del DNA en el tejido que rodea una lesión cancerosa, aunque no sea visible en el examen histológico habitual. Un estudio de validación reciente informó un valor predictivo negativo de este test superior al 90% en más de 400 hombres con una primera biopsia negativa 30. Actualmente, este examen está disponible en forma comercial en Estados Unidos y Europa.
Prostate Core Mitotic Test (PCMT): Es un examen en muestras de tejido que identifica depleción en el DNA mitocondrial asociado con cáncer prostático no diagnosticado. Al igual que el examen anterior permite detectar células malignas en el tejido de aspecto normal alrededor de un área de cáncer 31. También está disponible en forma comercial.
TMPRSS2-ERG: Es una fusión entre dos oncogenes predominantes en el 40 a 80% de los cánceres prostáticos. El nivel cuantitativo de este marcador en la orina parece estar asociado a cáncer significativo y utilizado en forma aislada o en combinación con PCA 3 permitiría predecir la presencia de cáncer en biopsias repetidas 32.
PTEN: Es un gen supresor envuelto en la regulación del ciclo celular. El test permite identificar deleciones parciales o completas del gene asociadas a progresión. En pacientes con lesiones intraepiteliales de alto grado (PIN de alto grado) permitiría distinguir lesiones no agresivas de aquellas asociadas a alto riesgo de cáncer y que requieren por lo tanto una nueva biopsia 33.
Biomarcadores para ayudar en la decisión de tratamiento
Score del Genoma Prostatico (GPS): Representa un análisis genómico de biopsias prostáticas y aunque la información disponible es actualmente muy limitada este score permitiría identificar una serie de oncogenes relacionados a una patología ofreciendo la posibilidad de discriminar pacientes para vigilancia activa o tratamiento 34.
Prolaris: Es un test genómico pronóstico que evalúa las mutaciones en la progresión del ciclo celular (CCP) y permitiría también discriminar pacientes para manejo o vigilancia activa 35.
Decipher: es otro ensayo genómico que permitiría evaluar el riesgo de progresión de los pacientes sometidos a prostatectomía radical. En un estudio de validación los pacientes de alto riesgo y con un score genómico alto tendrían una incidencia acumulativa de metástasis superior al 25%. Se ha recomendado utilizar este test en pacientes de alto riesgo para decidir la necesidad de tratamiento complementario 36.
Biomarcadores para evaluar la respuesta terapéutica
Tradicionalmente se ha utilizado la cinética del APE para evaluar la respuesta al tratamiento. Desafortunadamente, la discordancia entre este parámetro y la progresión clínica de la enfermedad no es poco frecuente, en especial en tratamiento citotóxico o incluso hormonal. Esto ha motivado el desarrollo de mejores marcadores de respuesta a tratamiento. No obstante, no hay muchos avances en esta área. El ensayo de células tumorales prostáticas circulantes, permite determinar el número de células tumorales presentes en muestras de sangre total. Un número alto puede predecir un mal pronóstico y una mala respuesta al tratamiento 37. Los métodos de detección actuales sin embargo, son limitados y en aproximadamente un 50% de los pacientes no es posible encontrar células tumorales circulantes.
Biopsia de próstata
La biopsia está indicada en cualquiera de las formas de presentación que hagan sospechar CaP: APE elevado y/o tacto rectal sospechoso de cáncer son las indicaciones más frecuentes. La técnica más utilizada es la biopsia transrectal guiada por ecografía, un procedimiento habitualmente ambulatorio en el que se toman muestras sistemáticas en un templado de al menos 12 cilindros. Este templado conocido como biopsia extendida es el más utilizado con una frecuencia de detección de cáncer cercana al 40%. Como veremos más adelante la estrategia de muestras por sextantes es poco utilizada actualmente, ya que se relaciona a una tasa de detección entre el 25 al 30%.
Otro tipo de templado es la biopsia por saturación, definido como un mínimo de 20 muestras, el cual se ha recomendado para las biopsias repetidas cuando una biopsia previa ha resultado negativa. En un estudio de más de 1.000 biopsia repetidas, Zaytoun demostró que con esta estrategia la frecuencia de detección de cáncer en biopsias repetidas era de un 33% comparado con un 22% cuando se utilizo el esquema de biopsia extendida 38.
La preparación para la biopsia en cualquiera de sus formas (ver más adelante) incluye un curso de administración de antibióticos orales, habitualmente ciprofloxacino o alguna cefalosporina y una limpieza rectal en forma de supositorios o enemas evacuantes. La preparación con enemas es de uso casi rutinario en la mayoría de los centros, sin embargo, no ha demostrado reducir por si solo la frecuencia de complicaciones. Se ha argumentado también que la presencia de heces en el recto puede distorsionar la imagen ecográfica. El uso de antibióticos, por otra parte, si ha demostrado ser efectivo en la prevención de complicaciones infecciosas, aunque no existe evidencia que un esquema sea mejor que otro o que la administración de una dosis sea superior a varios días de tratamiento 39.
La frecuencia de complicaciones infecciosas posterior a una biopsia transrectal de próstata se ha relacionado a la presencia de cepas fecales resistentes al antibiótico empleado en la profilaxis. En nuestra práctica evitamos el uso del mismo antibiótico si uno similar se ha usado para una biopsia previa o por otro motivo al menos durante los últimos seis meses. Aunque la frecuencia de complicaciones infecciosas es generalmente baja (1%), la prostatitis posterior a una biopsia prostática puede ser una complicación séptica grave particularmente en pacientes de más edad o con co-morbilidades que son relativamente frecuentes en los pacientes que se realizan este tipo de procedimiento.
En algunos centros se ha utilizado el screening prebiopsia de cepas resistentes a la profilaxis habitual con muestras de isopado rectal. Con esta estrategia se encontrado una prevalencia mayor al 20% de cepas resistentes a quinolonas. Sin embargo, su uso no se ha generalizado porque este screening no ha demostrado un beneficio significativo al compararlo con la orientación clínica y por supuesto redunda en mayores costos. Tampoco hay evidencia que apoye el uso rutinario del urocultivo antes de la biopsia prostática, aunque la gran mayoría de los pacientes tiene este examen en el proceso de decidir la necesidad de la biopsia.
Existen varias opciones para el uso de anestesia durante la biopsia, sin embargo, algunas modalidades que continúan usándose han demostrado ser poco efectivas. La inyección de anestesia perineal fue el estándar cuando se utilizaba la modalidad de biopsia prostática transperineal.
Cuando se incorporó la biopsia por vía transrectal al inicio de los años 80 inicialmente no se utilizaba anestesia. Por un lado, anestesiar localmente la mucosa rectal no parecía necesario ya que en general se considera que por encima de la línea dentada sobre el canal anal las sensaciones de dolor son mínimas. Por otra parte, en ese periodo la indicación habitual de la biopsia era por alteraciones en el tacto rectal y el número de muestras que se requerían era limitado a biopsias de un nódulo o áreas de mayor consistencia fácilmente palpables.
Al inicio de la década de los 90, se incorporó en forma habitual la técnica de biopsias por sextantes introducida por Hodge 40. Con esta modalidad, y sin el uso de anestesia, la gran mayoría de los pacientes manifestaba dolor durante el procedimiento. Aún, hoy en día, con el uso de anestesia local es mucho más fácil convencer a un paciente para que se realice una biopsia prostática por primera vez a que deba repetirse el procedimiento.
Desde la descripción original de Nash en 1996 y validado en numerosos estudios hasta hoy, el estándar para la biopsia prostática es el uso de anestesia local para bloqueo periprostático 41. Este tipo de bloqueo ha demostrado disminuir significativamente el dolor local durante el procedimiento. Existen aún opiniones diversas acerca del sitio ideal para el bloqueo de los haces nerviosos periprostáticos. La gran mayoría prefiere realizar el bloqueo en la base prostática. También se ha descrito el bloqueo en la línea media o a ambos lados del ápex, la inyección prostática directa y por supuesto combinaciones de estas técnicas.
En la descripción original de Nash se denominó al bloqueo periprostatico como la técnica del “monte Everest” y consistió en la administración bilateral de anestesia local a la formación piramidal de tejido adiposo hiperecogénico que es posible visualizar en el examen ecográfico sagital, en la unión de la base prostática y las vesículas seminales. La confirmación que la anestesia ha sido depositada en el lugar correcto está representada a la ecografía por una pápula hipoecogénica que desplaza anteriormente las bases de las vesículas seminales de la próstata y la pared rectal y la una pequeña lámina de anestésico entre la pared rectal y la próstata hacia caudal. En nuestra práctica, esta anestesia puede completarse con inyecciones adicionales en el espacio periprostático más caudal especialmente en la región más lateral y el ápex, donde con mayor frecuencia los pacientes experimentan dolor en la toma de las muestras. Se ha recomendado también utilizar una dosis adicional de anestésico intraprostático en esta zona.
Se ha sugerido que el dolor en el ápex correspondería a la estimulación de fibras de dolor del canal anal ya que la zona apical se encuentra muy cercana la línea dentada. En esta posición y con el uso habitual de transductores de disparo lateral es más probable incorporar fibras de dolor del canal anal más proximal.
Las muestras de la zona apical son cruciales por la mayor incidencia de cáncer en esta localización especialmente en la porción anterior o cuerno del ápex y desafortunadamente es la zona que con mayor frecuencia no se ha incorporado adecuadamente en la toma de las muestras. Se ha señalado que los fasos negativos de la biopsia prostática corresponden con mayor frecuencia a lesiones neoplásicas localizadas en la zona anterior del ápex por lo que habitualmente concentramos o agregamos algunas muestras adicionales a esta zona 42.
En la mayoría de los Centros, se ha mantenido la práctica de separar las muestras para el análisis histopatológico en cuadrantes, sextantes o distribuciones topográficas más numerosas. Sin embargo, la evidencia de que esta distribución tenga alguna importancia clínica es muy limitada y substancialmente más cara que el análisis de las muestras divididas según lateralidad 43. En términos prácticos, la información de lateralidad puede potencialmente predecir el lado con mayor probabilidad de extensión extracapsular y ser útil para planear el tratamiento 44.
Habitualmente utilizamos lidocaína al 1% y monitorizamos los signos vitales durante el procedimiento. No está de más recordar que la zona periprostática esta ricamente irrigada y hemos tenido casos de absorción rápida del anestésico local con síntomas de toxicidad sistémica.
El examen de la próstata con ultrasonido transrectal es esencial para determinar la ecoestructura de la glándula, su tamaño y ayudar a la distribución y localización de las biopsias. El transductor más utilizado es un transductor endorectal de 7,5 MHz que permite una visualización en los planos transverso y sagital y que tiene incorporado un canal para el desplazamiento de la aguja de anestesia y la de biopsia. Este transductor es generalmente cubierto con una funda desechable tipo preservativo y es descontaminado de acuerdo a las recomendaciones del fabricante.
El procedimiento puede realizarse en posición decúbito lateral o litotomía de acuerdo a las preferencias del operador. Sin embargo en nuestra experiencia la posición en decúbito lateral es mejor tolerada y permite una visualización más fácil de la región apical. Al examen ecográfico la zona periférica se presenta homogénea y discretamente más ecogénica que el resto de la glándula. Se debe describir la presencia de áreas o nódulos de distinta ecogenicidad (hipo, iso o hiperecogéncia), aunque ninguna representación ecográfica es específica de cáncer. La zona de transición, por su parte, es habitualmente heterogénea y con frecuencia se pueden apreciar pequeñas áreas hiperecogénicas que pueden generar sombra acústica (cálculos o calcificaciones prostáticas) o no (habitualmente descritos como “cuerpos amiláceos).
Es rutina durante este examen medir los tres diámetros de la glándula para calcular el volumen prostático. En el plano transverso habitualmente se miden el ancho (w) y el alto (h) y en el plano longitudinal el largo (l) o distancia entre el cuello vesical y el ápex prostático. La mayoría de los equipos de ultrasonido calcula en volumen en forma automática al entregarle el valor de estos diámetros. También se puede estimar el tamaño utilizando la fórmula para calcular el volumen de una esfera o un ovoide, aunque la más utilizada es la fórmula simple del volumen de un elipsoide:
(h) x (w) x (l) x 0.524.
La toma de muestras debe dirigirse especialmente al sector posterolateral y la región apical de la zona periférica prostática. Este tipo de muestreo permite aumentar la detección de cáncer comparado con la estrategia tradicional de muestras por sextantes y disminuye la probabilidad que el paciente requiera una nueva biopsia. Varios estudios prospectivos han mostrado que el rendimiento diagnóstico sobre 12 muestras es marginal y además podrían aumentar la detección de cánceres clínicamente no significativos. Desafortunadamente, en numerosas series publicadas la frecuencia de falsos negativos en biopsias de 12 cilindros excede todavía el 30% 45 y no mejora significativamente al aumentar el número de muestras 44.
El índice de complicaciones globales de la biopsia tradicional es de alrededor del 5%. Las más frecuentes son: hematuria (18-50%), hematospermia (30%), rectorragia (5-10%), retención urinaria (1-2%) y prostatitis (1%). En ocasiones puede haber fiebre alta y bacteriemia, que requieren un régimen antibiótico enérgico y hospitalización. La gran mayoría de estas complicaciones no requieren hospitalización y se pueden manejar de forma conservadora. Aunque las complicaciones hemorrágicas son frecuentes es poco común que los pacientes las perciban como una complicación mayor.
En los últimos años, como detallaremos más abajo, se ha incorporado la biopsia prostática dirigida por resonancia magnética (RM) como una estrategia para mejorar el rendimiento de la biopsia inicial como el de las biopsias repetidas. Se han descrito al menos tres modalidades de uso de la RM es este escenario 46,47:
1) La biopsia “cognitiva” que corresponde a la biopsia realizada bajo ecografía transrectal dirigida a la zona sospechosa señalada en la RM. Esta modalidad es más simple que las siguientes y no requiere un entrenamiento adicional. Se han descrito tasas de detección de cáncer de 54 a 69%, siendo la gran mayoría cánceres clínicamente significativos. La principal limitación de esta modalidad es la interpretación inadecuada del área señalada en la RM y la toma de muestras en sectores no sospechosos.
2) La biopsia por fusión de la RM y la ecografía transrectal que incluye el uso de softwares con la imagen almacenada de la RM superpuesta a la ecografía transrectal en tiempo real. En esta modalidad se reducen las limitantes de interpretación de la biopsia cognitiva sin embargo, requiere un entrenamiento especializado en el uso del programa. Para esta modalidad se han descrito tasas de detección de cáncer de un 54 a 55% siendo también la gran mayoría cánceres clínicamente significativos.
3) La biopsia realizada bajo RM. Esta modalidad tiene la ventaja de requerir un limitado número de muestras dirigidas directamente a la zona sospechosa sin embargo, es engorrosa, requiere mucho más tiempo que la biopsia tradicional y es más costosa.
La gran mayoría de los Centros realizan rutinariamente la biopsia prostática por punción transrectal guiada por ecografía con anestesia local y/o sedación. Sin embargo, algunas instituciones progresivamente han reincorporado la vía transperineal también guiada por ecografía transrectal. No se han demostrado grandes diferencias en la frecuencia de detección de CaP., aunque la vía trasperineal se asocia un mayor rendimiento en el apex y zona anterior de la prostata que como revisamos anteriormente son sitios de mayor detección de cáncer en biopsias repetidas. Por otro lado, la vía trasperineal se asocia a una menor frecuencia de complicaciones particularmente infecciosas. La mayor desventaja de esta técnica es que requiere mayor anestesia, habitualmente general o raquídea 46,48.
Resonancia Próstata y Biopsia de Transrectal de Próstata en el Diagnóstico de Cáncer de Próstata
Como se mencionó más arriba, el diagnóstico de CaP por muestreo histológico aleatorio sistemático sigue siendo el estándar 40. La biopsia transrectal sistemática (BS) de al menos 12 cilindros ha sido ampliamente recomendada para hombres con sospecha de CaP (TR alterdado y/o APE elevado) 49. Sin embargo, la BS tiene problemas para el diagnóstico de CaP por errores aleatorios en la toma de muestras y zonas de la próstata que habitualmente no se muestrean como, entre otras, la region anterior. Por esta razón, es que la BS ecoguiada podría no detectar hasta un 20% de los cánceres de próstata clínicamente signficativos 50 y por otra parte detectaría un porcentaje relativamente alto de CaP clínicamente insignificante (grupo de grado de Gleason [GGG] 1) lo que implica un sobrediagnóstico que conlleva un sobretratamiento y efectos colaterales que afectarían la calidad de vida 49.
Con la introducción de la resonancia magnética de próstata multiparamétrica (RNMmp), el flujograma para el diagnóstico de CaP ha cambiado. La RNMmp es una herramienta útil, ya que puede estratificar el riesgo de cáncer en una biopsia de próstata y entrega información espacial que permite dirigir la biopsia de la lesión informada por mpMRI. De esta forma, se detectarían más CaP clínicamente significativos (CS) (≥GGG 2) 51, disminuyendo el diagnóstico de CaP insignificante 52. Si bien la RM se utiliza para el estudio de la próstata desde de la década de los ochenta, los avances tecnológicos permitieron mejorar software y hardware logrando una mejor definición llegando a lo que conocemos como RNM próstata multiparamétrica (RNMmp). En el 2007 se crea el International Prostate MRI Working Group para estandarizar la técnica, interpretacion y reportes, de manera de disminuir la variación de informes entre radiólogos. Por lo anterior, la European Society of Urogenital Radiology crea el 2012 el Sistema de Información y Reporte de las Imágenes de la Próstata (PI-RADS). El PI-RADS informa la probabilidad de cáncer de próstata clínicamente significativo en lesiones detectadas por resonancia magnética multiparamétrica (RNMmp), definiendo como cancer de próstata clínicamente significativo a un ≥GGG 2 y/o volumen ≥ 0.5 cc y/o extensión extraprostática. De acuerdo a el estudio PROMIS 50, la RNMmp próstata tendría una sensibilidad de 87%, especificidad de 47%, VPP 69% y VPN 72% para un GGG 2. Las imágenes obtenidas incluyen imágenes potenciadas en T2, un estudio de contraste dinámico (ECD) y difusión por resonancia magnética (DWI). Es sumamente importante que el radiólogo pertenezca a un centro de alto volumen y que tenga experiencia en informar RNMmp de manera de disminuir la variabilidad interobservador. El uso de PI-RADS se limita a pacientes que no han recibido tratamiento previo y no se debe utilizar para etapificación, evaluación del resultado del tratamiento, recurrencia o progresión durante el seguimiento. La escala PI-RADS tiene un puntaje de 1 a 5 (que se da para cada lesión), siendo 1 de mayor probabilidad de benignidad y 5 altamente sospechoso de malignidad.
1 Muy probablemente benigno
2 Probablemente benigno
3 Indeterminada (12% CaP clínicamente significativo) 53
4 Probablemente maligno (60% CaP clínicamente signficativo) 53
5 Muy probablemente maligno (83% CaP clínicamente significativo) 53
Por estos características previamente mencionadas, es que actualmente la Asociación Europea de Urología (Guias EAU) 49 y las Guías del Instituto Nacional de Salud y Excelencia en la Atención (NICE) 54 recomiendan realizar una RNMmp en hombres sin biopsia previa con sospecha de CaP que vayan a ser sometidos a una biopsia prostática ya que ayuda detectar lesiones sospechosas permitiendo dirigir las biopsias y así aumentar la detección de CaP clínicamente significativos. Estas recomendaciones no son ampliamente adoptadas en EEUU, donde la RNMmp generalmente está reservada para hombres con una biopsia negativa previa. Sin embargo, en la última actualización de las Guía AUA correspondientes a Octubre 2019, el panel de expertos recomendaría que una RNMmp se debe realizar en pacientes que van a ser sometidos a una primera biopsia prostática 52. En caso que la RNMmp demuestre lesiones probablemente benignas (PIRADS 1 y 2), no se debe desechar realizar una biopsia si es que la sospecha es alta ya que se describe hasta 10% de falsos negativos.
Al momento de relizar la biopsia prostática transrectal y guiar la punción hacia la zona sospechosa (PIRADS 3-5), teoricamente se podría hacer sólo a esta zona disminuyendo el número de cilindros obtenidos y, por lo tanto, disminuyendo también potenciales complicaciones. Sin embargo, la combinacion BS (al menos 12 cilindros) más 4 a 5 cilindros en la zona sospechosa (PIRADS 3-5) parece detectar más cáncer próstata clínicamente significatvo que sólo realizar 4 a 5 cilindros a la zona sospechosa 53,55,56. Tanto las guías de EAU como las de la Asociación Americana de Urología (AUA) recomiendan actualmente realizar la biopsia sistemática más biopsia a lesiones sospechosas 49,57.
Biopsia de próstata dirijida a lesiones PiRADS (3-5) cognitiva (BC) versus fusión por software (BF)
La BC es atractiva ya que es rápida, fácil de realizar, y con un costo menor ya que no se requiere un dispositivo que fusione la imagen de la resonancia con la ecografia transrectal. Sin embargo, se debe considerar que estos sofisticados software de BF buscan disminuir el error en tomar la muestra ya que es difícil que el cerebro humano pueda que sólo con la informacion descrita en un informe radiológico e imagen de estática de una resonancia, lograr lo mismo que un software que esta fusionando las 2 imágenes (resonancia y ecografia). Sin embargo, al revisar la evidencia actual tratando de responder esta pregunta las conclusiones son conflictivas. En una revisión sistemática publicada por Valerio y cols. el 2014, concluye que la BF detecta un proporción mayor de cáncer de próstata clínicamente significativo que la BC (20,3% verus 15,1%) 58. En este misma línea, Delongchamps y cols. 59 evaluaron 391 hombres divididos en tres cohortes consecutivas sometidas a técnicas de BF elástica, rígida y BC, respectivamente. La BF rígida y elástica mejoró la detección de CaPcs en comparación con biopsia sistemática mientras que BC no mejoró la deteccion de CaPcs 59. Por otra parte, en el reciente estudio FUTURE , 665 pacientes con indicación de biopsia de próstata y lesiones PIRADS³ 3, se randomizaron a BF, BC y biopsia bajo resonancia sin encontrar diferencias entre las 3 técnicas de biopsia para el diagnóstico de CaPcs 60.
La técnica de biopsia por fusión sigue en desarrollo en paralelo con el mejoramiento de la RNM de próstata. Además, se investiga fuertemente en la asociación de biomarcadores asociados a las imágenes, para poder optimizar su rendimiento en la detección del cáncer de próstata.
Principios de tratamiento del cancer prostatico
Localizado y localmente avanzado
El tratamiento del cáncer de próstata depende de múltiples factores algunos de los cuales están graficados en la estratificación de riesgos que establecen las guías clínicas y otros se relacionan la condición clínica y expectativas del paciente, su sobrevida estimada y de la agresividad biológica del tumor.
En el caso de que la enfermedad se encuentre localizada a la próstata y el paciente tenga una expectativa de vida mayor a 10 años podemos ofrecer terapias con fin curativo. Existen múltiples alternativas y, entre éstas, las más avaladas por la literatura internacional y sociedades científicas son:
- Observación
- Vigilancia activa
- Prostatectomía radical
- Radioterapia externa
- Braquiterapia
Existen otras terapias en desarrollo, principalmente terapias focales, como la crioablación, el ultrasonido de alta intensidad (HIFU) y otros, que buscan ofrecer tratamiento focalizado a áreas de la próstata con el objetivo de ofrecer una terapia mínimamente invasiva y asi disminuir los efectos adversos del tratamiento. Por otra parte, es necesario señalar que no existen ensayos randomizados que hayan comparado una terapia con la otra para un mismo grupo de pacientes.
Actualmente tenemos un estudio randomizado (ProtectT) 61 que compraró tres estrategias de tratamiento en pacientes diagnosticados en estadio inicial en un programa de tamizaje, los resultados de ese estudio mostraron que aproximadamente la mitad de los pacientes randomizados a seguimiento activo requieren tratamiento activo y que tanto radioterapia externa como prostatectomía radical tienen resultados equivalentes.
En el caso de cáncer de próstata metastásico el tratamiento es eminentemente paliativo, esto es: atenuar los síntomas de la enfermedad y ofrecer mejor calidad de vida para una enfermedad incurable. El tratamiento estándar ha sido la hormonoterapia desde su introducción hace aproximadamente 40-50 años. Actualmente, la evidencia muestra que este bloqueo hormonal no debe darse de manera exclusiva. Esta, debe acompanarse de quimiterapia o terapia de bloqueo hormonal de ultima generacion segun sea el caso. Una vez que estas opciones fallen en frenar el avance de la enfermedad, es decir, que avanza a la etapa de resistencia a la castración, lo cual ocurrirá inevitablemente, existen distintas alternativas de tratamiento, de diversa índole y forma de acción, que han mostrado aumentar la sobrevida y calidad de vida en estos pacientes.
A modo de ejemplo, varios estudios randomizados han mostrado el beneficio en sobrevida global de agregar quimioterapia y medicamentos como la enzalutamida y la abiraterona.
Revisaremos más acerca de las alternativas terapéuticas actuales en esta etapa en la sección de cancer prostático avanzado
Estratificación de riesgo para enfermedad clinicamente localizada
La elección de tratamiento del cáncer de próstata considera la estratificación por grupos de riesgo de recurrencia que ha sido validada y proporciona una mejor base para recomendaciones de tratamiento que la sola etapa clínica (Tabla 1).
Aunque como veremos más adelante esta clasificación por grupos de riesgo no es perfecta y tiene un valor más limitado para el paciente individual, en particular al compararlo con el uso de nomogramas.
En el 2014, la Sociedad Internacional de Patología Urológica (ISUP) 2014 propuso otro sistema de clasificación del cáncer de próstata que permitiría a los pacientes comprender mejor su verdadero nivel de riesgo y de ese modo limitar el sobretratamiento 62. Este sistema asigna 5 grupos de grados de acuerdo al score de Gleason.
• Grupo grado 1: score de Gleason ≤ 6
• Grupo grado 2: score de Gleason 3+4=7
• Grupo grado 3: score de Gleason 4+3=7
• Grupo grado 4: score de Gleason 4+4=8; 3+5=8; 5+3=8
• Grupo grado 5: score de Gleason 9-10
El sistema ha sido validado en pacientes con cáncer prostático tratados con prostatectomía radical o radiación permitiendo predecir el riesgo de recurrencia después del tratamiento primario 63,64.
En el estudio de Epstein et al. 65 que incluyó 20.845 pacientes tratados con prostatectomía radical y 5.501 tratados con radioterapia en instituciones académicas la sobrevida a 5 años libre de recurrencia bioquímica después de la prostatectomía radical para los grupos grados 1 a 5 fueron 96% (IC 95%, 95-96),88% (IC 95%, 85-89), 63% (IC 95%, 61-65), 48% (IC 95%,44-52) y 26% (IC 95%, 23-30), respectivamente. La separación entre los grupos fue menos pronunciada en los pacientes sometidos a radioterapia (RT), probablemente debido al uso de terapia de deprivación de androgénicas (ADT) en los grupos de mayor riesgo. Varios estudios contemporáneos han validado también este nuevo sistema 66-68. La mayoría de las guías clínicas más utilizadas han incorporado los grupos de la ISUP en la estratificación de las categorías de riesgo (EAU, AUA, NCCN).
Persiste sin embargo, heterogeneidad dentro de cada grupo, en particular cuando se compara el riesgo de recurrencia asociada a pacientes incluidos por su etapa clínica T en los grupos de riesgo intermedio o alto con pacientes asignados al mismo grupo por su score de Gleason o nivel de APE 69-71.
| AUA 2017 (1) | EAU 2019 (2) | NCCN 2019 (3) | |
| MUY BAJO |
|
—- |
|
| BAJO |
|
|
|
| INTERMEDIO |
Favorable:
Desfavorable:
|
|
Facs. riesgo intermedio (FRI) :
Intermedio favorable :
Intermedio desfavorable:
|
| ALTO |
|
|
|
| MUY ALTO |
|
|
- Clinically Localized Prostate Cancer: AUA/ASTRO/SUO Guideline (2017): https://www.auanet.org/guidelines/prostate-cancer-clinically-localized-guideline#x6912
- EAU Prostate cancer guidelines (2019): https://uroweb.org/guideline/prostate-cancer/#1
- National Comprehensiva Cancer Network (NCCN) Guidelines. Prostate Cancer (version 4.2019): https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
Tabla 1. Estratificación de riesgo en Guías Clínicas de Cáncer Prostático Localizado
La heterogeneidad también está presente en pacientes de bajo riesgo. En el estudio de Dinh que incluyó mas de 10.000 pacientes de la base de datos del SEER diagnosticados con enfermedad de bajo riesgo (cT1c / T2a, APE < 10 ng/ml, Gleason 3 + 3 = 6) y tratados con prostatectomía un 44% de los casos correspondían finalmente a Gleason ≥ 7 y un 9.7% eran ≥ pT3. Estos pacientes no habrían sido candidatos a programas de vigilancia activa 72.
Este mismo grupo, al analizar pacientes de bajo riesgo también sometidos a tratamiento quirúrgico y que presentaban más del 50% de los cilindros de la biopsia con cáncer muestran que alrededor de uno de cada cinco presentaban un estadio pT3a-T4 o Gleason 8-10, lo que sugiere que estos casos no debieran incluirse en el grupo de bajo riesgo 72.
Aún considerando estas limitaciones, la estratificación por grupos de riesgo es una herramienta útil para recomendar las opciones de tratameinto en cada etapa. En el paciente individual el uso de nomogramas permite entregar información pronóstica mas detallada para la toma de decisiones.
Nomogramas
Los nomogramas son instrumentos predictivos que utilizan una serie de variables (entradas) y hacen predicciones sobre un resultado. En el caso de recurrencia en cáncer de próstata mientras mayor información clínica relevante se incluya el resultado es mas preciso. Como los nomogramas utilizan información de un paciente individual predicen de mejor manera el riesgo para ese paciente que los grupos de riesgo.
Los nomogramas pre-tratamiento permiten predecir la extensión del cáncer al diagnostico, el compromiso ganglionar linfático y los resultados a largo plazo posterior al tratamiento. Utilizan fórmulas estadísticas dinámicas basadas en información de un gran número de pacientes ya tratados. Estos modelos predictivos de acuerdo a la American Joint Committe on Cancer (AJCC) deben incluir en sus resultados la sobrevida como endpoint menos equívoco y mas robusto. Usar la sobrevida es especialmente importante en cáncer de próstata dada la lenta historia natural de la enfermedad. Además estos modelos debieran integrar el impacto del tratamiento, con el manejo conservador y las comorbilidades asociadas. Sin embargo, ningún modelo de este tipo es comúnmente utilizado en la práctica clínica habitual.
La tablas de Partin fueron las primeras en ser utilizadas en clínica. Introducidas en 1993 han sufrido varias actualizaciones, la última publicada en el 2013. Utilizan el valor del APE, score de Gleason de la biopsia y estadio clínico para predecir el estadio patológico del cáncer antes del tratamiento. La modalidad postoperatoria también conocida como tablas de Han, incluye variables de la anatomía patológica de la pieza operatoria y son utilizadas para predecir la recurrencia bioquímica posterior al tratamiento radical. Se ha desarrollado también varios otros nomogramas en centros dedicados al tratamiento del cáncer prostático. Los nomogramas de Kattan del Memorial Sloan Kettering Cancer Center también incluyen modelos pre y post cirugía radical y se han agregado además, herramientas predictivas para radioterapia de salvataje, riesgo de morir de cáncer de próstata en el periodo de recurrencia bioquímica y otros para calcular el riesgo de progresión utilizando el tiempo de doblaje del APE 73. Todas estas herramientas pueden integrarse en el manejo de un paciente determinado en distintas etapas de la enfermedad.
En la serie de prevención del cáncer de próstata (PCPT), se creó también una calculadora de riesgos en línea. La información de entrada de datos incluía edad, puntaje de PSA, origen étnico, antecedentes familiares, hallazgos del tacto rectal y resultados de la biopsia. Después de ingresar esos valores, la calculadora permitía predecir las probabilidades de cáncer de próstata de bajo o alto grado 74. Actualmente no se encuentra disponible el acceso en línea
Otro de los sistemas más utilizados es la evaluación del riesgo de cáncer de próstata desarrollado en la Universidad de California, San Francisco (UCSF-CAPRA). Originalmente descrito en 2006, se basa en factores clínicos que incluyen el valor del APE, score de Gleason, estadio T, edad del paciente y porcentaje de cilindros positivos de cáncer en la biopsia. Con un rango de puntaje de 0-10, se observa una sobrevida libre de recurrencia a 5 años en 85% para pacientes con un puntaje de 0-1 y 8% en pacientes con un puntaje de 7-10. Ningún paciente con un puntaje CAPRA de 0 se asocia al desarrollo de metástasis o mortalidad y cada aumento de un solo punto en el puntaje CAPRA se asocia con un riesgo creciente 75. Posteriormente se han realizado numerosos estudios de validación. Una revisión sistemática y metanálisis del 2013 analizó siete estudios de validación separados con una cohorte total de más de 12,000 pacientes y muestran que CAPRA pudo predecir con precisión la sobrevida libre de recurrencia bioquímica a 3 años en pacientes post-prostatectomía y la sobrevida libre de recurrencia en cada uno de los grupos de riesgo. Se han desarrollado variantes posteriores de la puntuación CAPRA, incluidas las que analizan el riesgo posquirúrgico (CAPRA-S) 76 y en pacientes sometidos a terapia de de privación de andrógenos primaria (ADT) (J-CAPRA) 77.
Si bien, el uso de CAPRA y sistemas de puntuación similares es relevante para predecir pacientes con probabilidad de desarrollar recurrencia bioquímica, su capacidad predictiva una vez que se ha establecido la recurrencia no está clara. Un estudio retros78pectivo de 2016 analizó pacientes posquirúrgicos que habían recibido radioterapia posterior, estratificados en función de las puntuaciones de riesgo CAPRA-S. Si bien se observó una tendencia hacia los puntajes CAPRA-S que predicen la supervivencia (P = 0.058), el puntaje fue capaz de predecir con precisión solo el tiempo hasta la recurrencia bioquímica y la ausencia de deprivación hormonal paliativa 78. Esto sugiere poca utilidad de la puntuación CAPRA en pacientes ya diagnosticados con BCR.
De uso más habitual son los nomogramas que permiten predecir el compromiso de ganglios linfáticos antes de tratamiento. Estos nomogramas permiten predecir el riesgo de compromiso linfático y decidir si es conveniente considerar la linfadenectomía pelviana. La necesidad de esta va a depender también de la modalidad de tratamiento que se va efectuar. El más utilizado en este contexto y que ha sido validado externamente es el de Briganti 79. En su actualización del 2017 incluye el APE de pretratamiento, estadio clínico, el grupo de grado de Gleason y el porcentaje de cilindros positivos con alto y bajo grado. En el caso de pacientes con información detallada de la biopsia, el valor de corte para recomendar la disección ganglionar se estableció en < 7%, para evitar aproximadamente el 70% de las linfadenectomías y perder solo el 1,5% de compromiso ganglionar linfático 80.
Se ha propuesto incluir también en las fórmulas predictivas la información entregada por la resonancia magnética multiparamétrica de próstata. La integración del sistema de reporte PI-RADSv2 mejoraría la exactitud de los nomogramas clínicos en predecir el riesgo de matástasis ganglionares linfáticas 81.
Una nueva actualización del nomograma de Briganti ha incluido la información de pacientes con una biopsia positiva dirigida por resonancia magnética multiparamétrica de próstata y biopsia sistemática concomitante. En su validación esta herramienta mostró que con el uso de un nivel de corte del 7% evitaría un número ligeramente menor de linfadenestomías (57%) en comparación con los nomogramas Briganti 2012 (66%), Briganti 2017 (60%) y MSKCC (62%) 82. Sin embargo, esto resultaría en un número sustancialmente menor de casos de de compromiso ganglionar perdidos en comparación con estos modelos (1.6% vs 4.6% vs 4.5% vs 4.2% para este modelo vs Briganti 2012 vs Briganti 2017 vs MSKCC, respectivamente). Los autores han recomendado no utilizar este modelo para individuos que fueron diagnosticados mediante biopsia sistemática y que la biopsia dirigida por resonancia magnética resultó negativa.
Recientemente, se ha propuesto la aplicación de plataformas genómicas a los sistemas de estratificación de riesgos. Un estudio de 2016 evaluó a 260 pacientes de riesgo intermedio a alto que se habían sometido a prostatectomía con un score de Gleason de 7 o más y un puntaje de CAPRA-S de 3 o más. Noventa y nueve pacientes en esta cohorte desarrollaron enfermedad metastásica y los autores encontraron que la inclusión del ensayo Decipher® aumentó el rendimiento pronóstico del modelo de riesgo CAPRA-S 83. Aunque está claramente limitado por su naturaleza retrospectiva, está claro que una combinación de sistemas de predicción con esfuerzos genómicos probablemente desempeñará un papel más importante en la evaluación futura de los pacientes.
Prostatectomía radical
Fundamentos
El objetivo de la cirugía es la remoción completa del tejido prostático. La persistencia del APE posterior a la operación es generalmente un indicador de tejido prostático residual que puede representar también, aunque no siempre, tejido tumoral residual, ya que en algunos casos puede corresponder a persistencia de tejido prostático benigno 84.
Esta situación es diferente de la recurrencia bioquímica en la cual el APE es indetectable posterior a la cirugía y después de un tiempo variable comienza a elevarse. El criterio de recurrencia bioquímica mas tradicional en la comunidad urológica es el de la Asociación Americana de Urología (AUA) que define como recurrencia un APE ≥0.2 ng/mL confirmado por una segunda determinación.
Esta definición tiene, sin embargo, limitaciones. No incluye los métodos supersensibles de determinación del APE y no es espécifica en establecer el periodo y extensión de la recurrencia metastásica. El método más ampliamente aceptado para predecir la recurrencia metastásica considera los factores clínicos iniciales (nivel de PSA, velocidad de PSA, categoría T y puntaje de Gleason de biopsia), hallazgos patológicos después de la cirugía y cinética de PSA posterior a la falla 85. Un estudio retrospectivo de 304 hombres que desarrollaron recurrencia bioquímica y no fueron tratados con terapia de rescate hasta el desarrollo de metástasis clínicas mostró que un tiempo de duplicación de PSA (PSADT) de <10 meses, puntajes de Gleason de prostatectomía más altos (puntajes de Gleason 8-10), y un el intervalo más corto entre el tratamiento y la recurrencia (≤2 años) se asociaron independientemente con el desarrollo de metástasis 86. En los pacientes que son candidatos, la prostatectomía radical por cáncer prostático localizado, ofrece beneficios en términos de sobrevida cáncer específico. El estudio SPCG-4 comparó la prostatectomía radical con la conducta expectante (watchful waiting) en pacientes con cáncer prostático localizado 87. El seguimiento extendido confirmó que los pacientes sometidos a prostatectomía radical presentaron una reducción substancial en la frecuencia de muerte por cualquier causa, muerte por cáncer prostático, riesgo de metástasis o el uso de deprivación androgénica. Estos beneficios se mantuvieron en el curso del tiempo y fueron más pronunciados en los pacientes menores de 65 años y con tumores de riesgo intermedio. Por otro lado, en los pacientes mayores de 65 años sometidos a cirugía radical disminuyó significativamente el riesgo de metástasis y la necesidad de tratamiento paliativo lo que apoyaría que los pacientes de mayor edad pero con una larga expectativa de vida también se beneficiarían del tratamiento quirúrgico.
Recientemente, este grupo pubicó los resultados después de 29 años de iniciado el estudio con un seguimiento medio de 23.6 años y confirmaron el benefico de la cirugía. La incidencia acumulada para metástasis a distancia fue de 26,6% en el grupo de prostatectomía radical y 43,3% en el de conducta expectante (p<0.001).El grupo sometido a prostatectomía radical se asoció a 2,9 años de vida ganados con un beneficio absoluto de 12% para la mortalidad global con un iresgo relativo en favor de la prostatectomía de 0,71 (IC 95%, 0.59 – 0.85; p<0.001) y 11,7% para la mortalidad cáncer específica, lo que se tradujo en un riesgo relativo de morir por cáncer prostático de 0,54 (IC 95%, 0.41 – 0.74; p<0.001)
El estudio PIVOT 88 también incluyó pacientes con cáncer prostático localizado randomizados a observación o prostatectomía radical. A los pacientes asignados a observación se ofreció tratamiento paliativo en la eventualidad de progresión sintomática de la enfermedad o metastásica. El seguimiento de estudio que también se actualizó recientemente es menos prolongado que el estudio SPCG-4 con una mediana de 12.7 años años y aunque no se observó una diferencia estadística en la sobrevida global o cáncer específica de ambos grupos, los pacientes asignados a prostatectomía radical presentaron al final del estudio una frecuencia menor de tratamiento por progresión un 5,5% menos de mortalidad por cualquier causa que el grupo de observación y una disminución significativa en la incidencia de metástasis óseas 89. Estos resultados son similares al análisis de seguimiento de 10 años del estudio SPCG-4. Solo un seguimiento más a largo plazo puede revelar si los resultados de PIVOT podrán replicar los resultados del SPCG-4.
Numerosos estudios no randomizados han mostrado que la prostatectomía radical se asocia a una mejor sobrevida global al compararla con la radioterapia externa o la braquiterapia, sin embargo, no han demostrado diferencia significativa en la mortalidad cáncer específica 90,91. Como se trata de estudios no randomizados, pueden existir sesgos importantes para interpretar adecuadamente esta información. Es probable, por ejemplo, que los pacientes más jóvenes y con menos patologías asociadas estén más representados en los que fueron sometidos a cirugía radical.
Basado en la información que han entregado los estudios observacionales los síntomas urinarios irritativos y obstructivos serían más frecuentes con la radioterapia, especialmente con la braquiterapia. La incontinencia es más frecuente con la cirugía radical y mejora gradualmente en el tiempo. Los síntomas intestinales como urgencia y frecuencia son mucho más frecuentes con la radioterapia y braquiterapia. La disfunción eréctil es más común en la prostatectomía radical aunque las diferencias no son significativas después de dos años de tratamiento.
Recientemente el estudio PROTECT presentó sus resultados a 10 años de seguimiento que incluyó a 1643 pacienes con cancer prostatico localizado que se distribuyeron en forma aleatoria a monitoreo activo (n=545), prostatectomia radical (n=553) o radioterapia externa (n=545) 61.
La edad media de los pacientes fue de 62 años y el valor medio del APE 4.6 ng/dl (rango 3-19.9 ng/mL). Un 77% de los pacientes tenían score de Gleason 6 y un 76% correspondían a estadío clínico T1c, sin diferencias significativas entre los tres grupos.
En el grupo de monitoreo activo más de la mitad de los pacientes recibieron tratamiento en el periodo de seguimiento y en análisis final se consideró la intención de tratamiento. La mortalidad global fue aproximadamente de un 10% y similar en los tres grupos. La mortalidad cáncer específica fue muy baja y sin diferencias significativas entre los grupos (1,2%, 1% y 0,4% para monitoreo activo, cirugía y radioterapia; respectivamente). El grupo de monitoreo activo sin embargo, presentó una mayor incidencia de progresión (22,9% v/s 8,9% y 9% para prostatectomía radical y radioterapia; respectivamente) y metástasis (6,3% v/s 2,4% y 3%). Esta misma cohorte presentó un análisis de encuestas reportada por los pacientes acerca de los efectos adversos del tratamiento asignado considerando cuatro dimensiones: función urinaria, sexual, intestinal y calidad de vida. Los efectos negativos de la prostatectomía radical sobre la continencia urinaria y sexual, particularmente la función eréctil fue mayor a los 6 meses de tratamiento y aunque hubo cierta recuperación en el seguimiento, el efecto fue peor que en los otros dos grupos. La cirugía no se asoció a cambios en la función intestinal. A los 6 meses el efecto negativo de la radioterapia y deprivación androgénica asociada sobre la función sexual y particularmente sobre la función eréctil fue solo un poco menor que la prostatectomía radical. La función intestinal y la nicturia fueron peores en este grupo sin embargo, hubo una recuperación significativa en el seguimiento. En el grupo de monitoreo activo los efectos adversos fueron significativamente menores que en los otros grupos de tratamiento pero empeoraron gradualmente con el tiempo en la medida que un número creciente de pacientes recibieron tratamiento radical o envejecieron. La función intestinal no se modificó en el seguimiento.
Como no existe evidencia definitiva que permita clarificar que modalidad de tratamiento ofrece las mejores expectativas en los pacientes con cáncer prostático localizado, se considera que cualquiera de estas es equivalente y sus diferencias tienen que ver más con las eventuales complicaciones de cada tratamiento, que con sus efectos sobre el control de la enfermedad.
Actualmente se encuentra en etapa de reclutamiento de pacientes, un estudio que tiene como objetivo comparar en un modelo de no inferioridad, con un seguimeinto máximo de 17 años y en un número significativo de pacientes, la sobrevida cáncer específica de radioterapia externa, braquiterapia y vigilancia activa con la prostatectomía radical. Este grupo al momento del desarrollo de este capítulo aún no había publicado resultados 92.
La prostatectomía radical constituye una de las opciones de tratamiento para los pacientes con cáncer prostático localizado junto con otras que revisaremos más adelante. Este procedimiento solo está indicada en pacientes muy seleccionados con metástasis a distancia o cuando el tumor se ha extendido localmente y se encuentra infiltrando estructuras vecinas en la pelvis, y en general en estos casos forma parte de un tratamiento multimodal. Aunque no existe un límite definido de edad, generalmente se ha recomendado considerar este procedimiento en pacientes con cáncer localizado y que tienen una expectativa de vida superior a los 10 años. Esta recomendación está basada en que la evolución de este cáncer en pacientes con enfermedad localizada a la próstata puede superar este periodo, especialmente en tumores de menor riesgo, y por otro lado la presencia de co-morbilidades o edad avanzada aumentan las probabilidades de muerte por causas no relacionadas al cáncer prostático.
La prostatectomía radical se puede efectuar vía trasperineal, sin embargo, la vía retropúbica es la que ha ganado mayor popularidad. También se puede abordar por vía laparoscópica o asistida por robot y cuando está indicado se puede asociar a la linfadenectomía pelviana.
La prostatectomía robótica ofrece ventajas al compararla con la técnica laparoscópica estándar, incluyendo instrumentos articulados, control del temblor y visualización tridimensional 93. Todas estas mejorías permiten acortar significativamente la curva de aprendizaje, una de las limitantes mayores de la prostatectomía laparoscópica 94.
Varias revisiones sistemáticas han comparado la prostatectomía laparoscópica y robótica con el abordaje abierto. Los resultados de estos análisis han sido inconsistentes. Generalmente estas técnicas se asocian con una estadía hospitalaria más corta y menor necesidad de transfusiones. Sin embargo, la gran mayoría de las publicaciones incluidas no compara los resultados oncológicos a largo plazo e incluyen numerosos estudios retrospectivos de baja calidad 95. Una de estas revisiones sistemáticas recientes que incluyó un metanálisis de 33 estudios reportó que la prostatectomía robótica se asoció a menor pérdida de sangre y requerimientos de transfusiones y mejor recuperación de la continencia y de la función eréctil. La presencia de márgenes quirúrgicos comprometidos fue menor en la técnica robótica al compararla con la laparoscópica y similar al abordaje abierto 96. No entregó, sin embargo, información relacionada a recurrenia bioquímica en el largo plazo.
Otra revisión sistemática y metanálisis de la Cochrane incluyó solo ensayos controlados aleatorios y resultaron elegibles solo dos series publicadas incluyendo 446 pacientes en que se compararon las tres técnicas. Este estudio concluyó que la recuperación de la función urinaria y sexual eran similares. También resultaron similares las complicaciones generales y postoperatorias. La diferencia en el dolor posoperatorio fue mínima. Los pacientes sometidos a prostatectomía robótica y laparoscópica se asociaron a una estadía hospitalaria más corta y menor frecuencia de transfusiones de sangre. Todos los datos disponibles fueron a corto plazo y ninguno de los estudios incluyó resultados de recurrencia bioquímica o sobrevida 97. Entendiendo que la prostatectomía robótica es de uso universal y también en Chile, describiremos más en extenso la técnica retropúbica, técnica que es la más usada en los Centros formadores a nivel nacional.
Prostatectomía abierta retropúbica
La prostatectomía retropúbica en centros con volumen adecuado de procedimientos es una cirugía segura con pocas complicaciones.
Con una selección apropiada de pacientes los márgenes quirúrgicos positivos se presentan en ≤ 20% y la enfermedad confinada al órgano en el 85-90% de los casos. La recuperación de la continencia después de la cirugía es superior al 90% y la función eréctil en más del 70%.
Los aspectos técnicos de la prostatectomía radical retropúbica están ampliamente descritos y cada cirujano generalmente desarrolla alguna variante personal muy similar a la técnica estándar. Lo esencial comienza con una buena exposición. La incisión puede ser transversa tipo Pfannenstiel, aunque en nuestra práctica hemos utilizado con mucha mayor frecuencia la incisión vertical desde el pubis hasta un par de centímetros bajo el ombligo. El uso de un retractor de Bookwalter es bastante útil tanto para la cirugía prostática propiamente tal como para la realización de la linfadenectomía cuando corresponde.
El procedimiento quirúrgico comprende la extirpación de la glándula prostática en bloque con las vesículas seminales y la ampolla del conducto deferente. Tradicionalmente, se ha recomendado un tiempo de espera de 4 a 6 semanas entre la biopsia prostática y la cirugía radical, asumiendo que en este periodo se estabiliza el proceso inflamatorio secundario al procedimiento y desaparecen potenciales hematomas. No es muy claro el origen de esta recomendación. Aparentemente estaría relacionada al tiempo de descenso del APE cuando se trata un proceso inflamatorio que comprometa la próstata y un periodo de tiempo razonable antes de que se establezca la fibrosis. Sin embargo, los estudios que han comparado la cirugía antes o después de este periodo han mostrado resultados diversos, en algunos casos no presentan diferencia y en otros se recomienda ese tiempo de espera 98-100. Por otro lado, períodos de espera para cirugía mayores a 90 dias, en particular en cánceres localizados de alto riesgo, se han asociado a mayor frecuencia de recurrencia bioquímica 101.
La exposición del espacio de Retzius puede desarrollarse en forma roma y se reseca a continuación el tejido adiposo cercano al ápex mediante una pinza de ganglio y el electrocuterio. Una apertura amplia de la fascia endopelviana a ambos lados permite controlar rápidamente el complejo venoso dorsal. Aquí resulta útil el uso de un pequeña tórula para separar las adherencias de la fascia endopelviana a la superficie lateral de la próstata y los músculos elevadores. Las pequeñas venas que con frecuencia constituyen algunas de estas adherencias pueden controlarse fácilmente con la pinza bipolar teniendo cuidado para no dañar la bandeleta neurovascular cercano a la pared lateral de la próstata. La sección de los ligamentos puboprostáticos no siempre es necesaria y los seccionamos solo cuando dificultan acceder al complejo venoso dorsal.
Algunos cirujanos desarrollan un plano entre el complejo venoso y la uretra con un ángulo recto antes de ligarlo. En nuestra práctica en este punto movilizamos poco la uretra intentado dañar lo menos posible el complejo esfinteriano y habitualmente controlamos las venas dorsales mediante uno o dos puntos transfixiantes de vicryl 1-0. Puede ser útil en esta etapa el uso de un clamp de Babcock proximal y/o un punto transfixiante de vicryl 2-0 para controlar las ramas venosas cercanas a la unión prostatovesical. Esta maniobra es una modificación de la técnica descrita originalmente por Myers y evita el sangrado retrógrado cuando se divide el complejo venoso dorsal 102. A continuación se secciona el complejo dorsal exponiendo la superficie anterior de la uretra. En esta disección se separa la proyección del la bandeleta neurovascular lateral a la uretra en su camino hacia el diafragma urogenital. Un disector en ángulo recto permite separar también la pared posterior de la uretra. En el caso de preservación de bandeletas se procede a liberar inicialmente el plano de la fascia prostática lateral a ambos lados desde el ápex hasta el pedículo vascular posterior con disección roma y cortante dejando las bandeletas superficial al recto y comunicando con el plano posterior de la fascia de Denonvilliers.
En esta maniobra es de gran utilidad el uso de un elevador de Penfield o un disector fino y rotar la próstata suavemente en el sentido contrario a la disección. Algunos cirujanos inyectan previamente suero fisiológico en el plano de la fascia lateral de la próstata para facilitar la disección o utilizan una tórula para desplazar la bandeleta al plano inferior.
La sección uretral la realizamos con bisturí frío inmediatamente subapical, preservando la sonda uretral que se corta a nivel del meato externo. Algunos aprovechan esta etapa para instalar las suturas de la pared anterior de la uretra. La tracción de la sonda permite exponer la superficie posterior de la próstata. Esta disección es facilitada por dos maniobras adicionales. La sección de las fibras musculares del rectouretral en la situación más cefálica posible y el desarrollo del plano posterior a la fascia de Denonvilliers. Para liberar las vesículas seminales se requiere acceder al plano anterior de la fascia de Denonvilliers y seccionar la ampolla de los vasos deferentes.
La disección de ambos vasos deferentes hacia la profundidad es un plano seguro y facilita el acceso al fondo de las vesículas seminales. Es recomendable ligar o clipear los vasos del fondo vesicular para desprender completamente las vesículas. En ocasiones el plano perivesicular se encuentra adherido firmemente como consecuencia de biopsias repetidas u otros procesos inflamatorios. En estas condiciones puede ser recomendable completar esta etapa con un abordaje anterógrado similar al desarrollado en el abordaje laparoscópico. Finalmente, se trabaja el plano prostatovesical para una apertura mínima a nivel del cuello vesical y se extrae la pieza. No es un procedimiento de rutina pero en algunas ocasiones puede requerirse una biopsia rápida de bordes especialmente cuando hay dudas respecto a preservar una de las bandeletas en pacientes de con cáncer de alto riesgo 103.
Dependiendo de la apertura del cuello es la necesidad de reconstrucción. Cuando la apertura está muy cercana a los orificios ureterales preferimos una reconstrucción en “W” que permite alejar los meatos ureterales del plano de la anastómosis uretrovesical. Cuando los meatos se encuentran lejos del borde de sección del cuello vesical, la reconstrucción estándar, si se requiere, es en forma de “raqueta” con vicryl 3-0. Un paso habitual en esta etapa es la eversión de la mucosa del cuello vesical. Desde la descripción clásica de Walsh la eversión de la mucosa del cuello vesical se ha considerado como una maniobra recomendable para reducir el riesgo de estrechez del cuello vesical. La evidencia sin embargo es pobre y los pocos trabajos prospectivos que han estudiado este aspecto no han demostrado que la eversión la mucosa tenga algún impacto en la prevención de la estenosis 104.
Rutinariamente no efectuamos una reconstrucción musculofascial posterior tipo Rocco. La evidencia que esta maniobra pueda contribuir a la recuperación más rápida de la continencia es controvertida y ha renacido en los últimos años con la prostatectomía radical robótica 105.
La anastomosis uretrovesical se completa habitualmente con seis suturas de vicryl o monocryl 2-0 sobre una sonda siliconada 20 French, controlando que no se afecten los haces neurovasculares. En esta etapa es recomendable retirar los retractores superiores para permitir un descenso laxo del cuello vesical. El uso de un par de tampones cuando se anudan las suturas permite además exponer y acercar la línea de sutura. En ocasiones resulta útil además un tampón perineal para ascender el muñón uretral. Los pacientes generalmente permanecen hospitalizados dos o tres días, se van de alta con la sonda uretrovesical y son citados al día 10 para el retiro de esta y un prueba miccional.
Linfadenectomía pelviana
El beneficio clínico y la necesidad de la linfadenectomía durante la prostatectomía radical ha sido un tópico de debate por varios años. La proporción de pacientes que son sometidos a lifadenectomía se ha incrementado en la medida que la extensión anatómica del procedimiento también se ha extendido. En un estudio que incluyó centros de alto volumen en cirugía de cáncer prostático casi un 60% de los pacientes fueron sometidos a este procedimiento incluyendo un 34,5% de pacientes de bajo riesgo sin embargo, el compromiso ganglionar linfático se confirmó solo en un 4,1% 106.
Desafortunadamente, la mayoría de las publicaciones que han analizado el efecto de la linfadenectomía corresponden a estudios retrospectivos y no randomizados con baja calidad de evidencia.
En una revisión sistemática reciente que incluyó más de 275.000 pacientes de 66 estudios seleccionados solo cuatro de ellos corrrespondían a series clínicas randomizadas. Con esta evidencia limitada se confirmó el valor de la linfadenectomía como procedimiento de etapificación pero no se observó ningún beneficio pronóstico o terapéutico 107.
Tradicionalmente la disección linfática ha sido limitada a la fosa obturadora y los ganglios linfáticos asociados a la vena iliaca externa. Sin embargo, el drenaje linfático de la próstata no es constante y con frecuencia puede no incluir primariamente estos grupos ganglionares y derivar hacia ganglios linfáticos asociados con los vasos iliacos comunes, hipogástricos, paraórticos, presacros o perirrectales.
Por este motivo el templado estándard de ganglios centinela en cáncer de próstata no se ha establecido como en otros cánceres 108.
Estudios con inyección intraprostatica de tecnesio 99 con uso de SPECT y cintigrama planar han mostrado que el drenaje linfático primario a menudo se encontraron sitios fuera del área de disección de la linfadenectomía 109.
En una revisión sistemática que incluyo más de 25.000 pacientes se evaluó el rendimiento de la resección de ganglios centinela. La conclusión de este análisis fue que la resección dirigida de los ganglios centinela se relaciona a una precisión diagnóstica comparable a la linfadenectomía extendida, parece aumentar el número de ganglios afectados cuando se combina con con el templado extendido y se puede considerar su uso en pacientes de alto riesgo 110.
Se han descrito diferentes templados para la linfanectomía en relación a los diferentes ejes vasculares pelvianos incluidos en la disección (Figura 1).
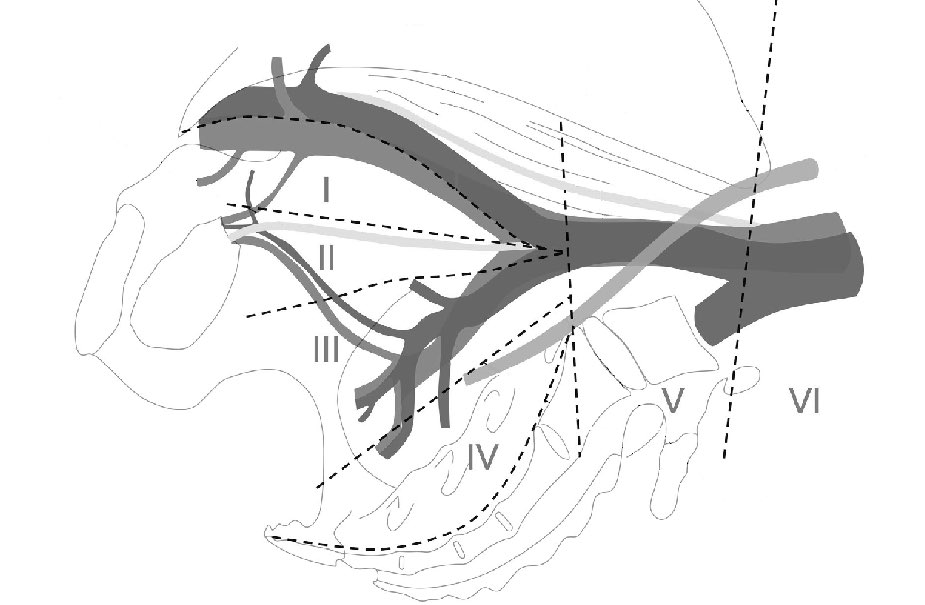

I = ganglios iliacos externos; II = ganglios obturadores; III = ganglios ilíacos internos; IV = ganglios presacrales; V = ganglios iliacos comunes; VI = ganglios suprailiacos
LDNP limitada (LDNP-L), ganglios obturadores; LDNP estándar (LDNP-S), obturador y ganglios ilíacos externos; LDNP extendida (LDNP-E), obturador, ganglios ilíacos externos e internos; LDNP súper extendida (LDNP-SE), LDNP-E más ganglios ilíacos presacrales y ganglios iliacos comunes
La disección en la modalidad extendida es la más utilizada actualmente e incluye lateralmente el tejido fibroaereolar que rodea y se extiende medial a la arteria iliaca externa, la arteria iliaca interna y la bifurcación de la vena iliaca externa e interna como límite superior, el origen de la vena circunfleja superficial como límite inferior y la pared lateral de la pelvis en la fosa obturatriz como límite medial. Este templado de disección puede incluir también los ganglios linfáticos del aspecto medial de la arteria iliaca común hasta el cruce de los uréteres. El estudio de Mattei mostró que dentro de esos límites se encontraba el 75% del drenaje primario de la próstata comparado con un 38% limitado al campo de disección tradicional 111.
Si bien no se ha determinado la extensión óptima de la disección linfática, la evidencia actual sugiere que una disección más amplia es preferible, en particular en los pacientes de más alto riesgo. La disección más extensa puede identificar compromiso ganglionar cuando una disección tradicional es negativa. Una información más precisa puede permitir seleccionar a los pacientes para terapia adyuvante. Varios estudios han mostrado que en la presencia de compromiso ganglionar limitado la terapia de deprivaciión androgéncia o la combinaciión con radioterapia pueden asociarse a beneficios en sobrevida 112-114.
Por otro lado, estudios observacionales apoyan algún rol curativo de la linfadenectomía más amplia cuando existe y se han podido resecar los ganglios linfáticos con compromiso metastásico microscópico, el cuál es más frecuente en pacientes con cáncer de mayor riesgo.
En una revisión sistemática y metanálisis contemporánea que incluyó más de 1.500 pacientes se comparó el pronóstico oncológico entre la linfadenectomía estándar y extendida durante la prostatectomái radical en pacientes con cáncer de prostata de riesgo intermedio y alto. La sobrevida libre de recurrencia bioquímica fue mejor en los pacientes con linfadenectomía extendida (HR 0.71; IC 95% 0.56-0.09, p=0.005) 11. Varios estudios han reportado además una asociación entre el número de ganglios linfáticos obtenidos en la linfadenectomía y el pronóstico oncológico. La obtención de más de 10 ganglios linfáticos y el número total de ganglios positivos para metástasis se ha relacionado a una mejor sobrevida libre de recurrencia bioquímica en pacientes con cáncer de próstata de riesgo itermedio y alto 115. También se ha relacionada el número de ganglios linfáticos resecados con la sobrevida específica libre de cáncer 116.
En un análisis multinstitucional reciente que incluyó pacientes de centros europeos y de estados unidos el riesgo de recurencia bioquímica posterior a radioterapia de salvataje se asoció inversamente con el número de ganglios resecados en la prostatectomía radical . La extensión de la disección también se asoció de forma independiente con una disminución del riesgo de recurrencia clínica después de la radioterapia de salvataje. Estos datos respaldan la importancia de una linfadenectomía extendida en la cirugía y se pueden usar en la evaluación del pronóstico cuando se considera la la radioterapia de salvataje 117.
Otros estudios han sugerido que la linfadenectomía extendida puede asociarse a mejoría en sobrevida, incluso en pacientes sin compromiso ganglionar (pN0) 118. Para explicar esto se ha propuesto la que la resección de ganglios linfáticos catalogados como negativos por el examen patológico de rutina pueden contener micrometastasis. En un estudio en que se utilizó RT-PCR y tinción inmunohistoquímica con un anticuerpo monoclonal contra el APE, el análisis de ganglios linfaticos resecados durante prostatectomía radical encontró un 23% de micrometástasis en muestras informadas como negativas por el examen habitual 119. La supervivencia libre de recurrencia bioquímica en pacientes con micrometástasis fue significativamente menor que en aquellos sin micrometástasis. Sin embargo, no todas las micrometástasis progresarán y el beneficio terapéutico de la resección de ganglios negativos en el cáncer de próstata aún no se ha aclarado. Por otro lado, el compromiso ganglionar no es el único determinate de recurrencia y progresión. La prevalencia de otros factores patológicos desfavorables como la extensión intraglandular del cáncer, la extensión extracapsular y la presencia de bordes quirúrgicos positivos son generalmente más frecuentes o están asociados al compromiso ganglionar y estos factores no serán influenciados por la extensión de la linfadenectomía 120.
En el registro de ClinicalTrial.gov, figuran en curso al menos dos estudios prospectivos que comparan la linfadenectomía de templado extendido y la linfadenectomía limitada en pacientes con riesgo intermedio y alto (NCT01812902; NCT01555086). Aunque el seguimiento total no se ha completado una de ellas ha presentado sus resultados oncológicos preliminares con una media de seguimiento de 3 años 121. El templado extendido permitió obtener un número significativamente mayor de ganglios linfáticos (17 versus 3; p<0.001), sin embargo, no se observaron diferencias entre ambos grupos en la frecuencia de recurrencia bioquímica, necesidad de radioterapia, hormonoterapia, aparición de metástasis óseas o muerte. El seguimento completo permitirá obtener información respecto a diferencias en un plazo más largo.
En las guías clínicas la recomendación de la linfadenectomía pelviana está determinada por el riesgo de compromiso de los ganglios linfáticos regionales. Esta información puede incluirse en herramientas predictivas como los Nomogramas. La recomendación actual es utilizar nomogramas basados en Linfadenectomías extendidas. Entre los más utilizados y que han sido validados externamente estan los de Briganti 79,80 y los del MSKCC que pueden accederse en línea.
Como hemos visto, estos nomogramas permiten predecir el riesgo de compromiso linfático y decidir si es conveniente considerar la linfadenectomía. La necesidad de esta va a depender también de la modalidad de tratamiento que se va efectuar. La recomendación en guías clínicas es omitir este procedimiento en los pacientes con bajo riesgo, donde la prevalencia de compromiso ganglionar es ≤2% (NCCN 2019) o ≤ 5% (EAU 2019). En todos los pacientes que no cumplan criterios clínicos y de laboratorio de bajo riesgo está indicado este procedimiento. La biopsia contemporánea de los ganglios linfáticos resecados solo se recomienda cuando se encuentra una compromiso regional importante para decidir si continuar o no con la prostatectomía. Uno de los aspectos técnicos más importantes en la linfadenectomía, es la ligadura rigurosa de los vasos linfáticos como una manera de prevenir el desarrollo de linfoceles. El usó solamente del electrocauterio es insuficiente.
Vigilancia Activa
La vigilancia activa involucra un monitoreo permanente en el curso de la enfermedad con el objetivo de indicar un tratamiento curativo si se reconocen elementos de progresión. A diferencia de la observación la vigilancia activa es aplicable a pacientes más jóvenes con cáncer estratificado como indolente con la finalidad de diferir el tratamiento y sus efectos adversos. Es actualmente una opción terapéutica, gracias a que se conoce mejor la historia natural del cancer de próstata. La incorporación del APE implicó que el riesgo de diagnóstico de CaP durante la vida aumentara de 8% a 17%, siendo este riesgo 6 veces mayor que la probabilidad de morir por el mismo CaP 122.
Estudios han mostrado que es necesario tratar a 48 pacientes con CaP localizado para evitar una muerte por cáncer, la que se producirá en pacientes de riesgo intermedio o alto, mientras que la mayoría de los hombres de bajo riesgo, probablemente nunca tendrán progresión de la enfermedad 122.
Por otro lado, las características del cáncer difieren profundamente entre los dos patrones más comunes de enfermedad, Gleason 3 y Gleason 4. En la mayoría de los casos, las anormalidades moleculares asociados con el cáncer están ausentes en el patrón de Gleason 3 particularmente en el caso de genes que regulan vías oncogénicas claves 123. Por ejemplo genes involucrados en la proliferación se expresan en forma normal en el patrón de Gleason 3 y anormalmente en 4. Genes involucrados en la invasión celular y metástasis, y los genes que regulan la transición del ciclo celular no se sobreexpresan en Gleason 3, pero están presentes en Gleason 4. Lo mismo sucede con genes asociados a la resistencia a la apoptosis, angiogénesis y regulación del metabolismo celular
Una fracción significativa de pacientes diagnosticados con cáncer de próstata tienen una enfermedad de bajo riesgo (score de Gleason 6 o Grupo gado 1) y hay un consenso emergente de que la mayoría de estos pacientes no se benefician de un tratamiento radical. El potencial metastásico del score de Gleason 6 es mínimo o no está presente y, en los pocos casos en que se han encontrado metastasis la revisón de la histopatología ha mostrado habitualmente un Gleason mayor 124.
Por otra parte, la radioterapia, al igual que la prostatectomia radical, ambos tratamientos tradicionales del cancer prostatico, pueden producir incontinencia urinaria (1% para la radioterapia y 7-15% para la prostatectomia radical) y disfunción eréctil (30-45% para la radioterapia, 29-100% para prostatectomia radical), entre otras complicaciones 125,126. Incluso la prostatectomia radical presenta un riesgo de mortalidad de 0.5% a 30 días. Además, la Prostatectomía Radical (PR) no disminuiría de manera significativa la mortalidad general y específica en pacientes con CaP de bajo riesgo comparado con observación, a 10 años de seguimiento 127,128.
El cáncer de próstata se desarrolla en la mayoría de los hombres con la edad. En hombres caucásicos se ha señalado que la probabilidad de albergar un cáncer de próstata es aproximadamente la edad como porcentaje, comenzando en los 30s 129. Esta tendencia ha sido confirmada en estudios de autopsias de caucásicos, asiáticos y otros grupos étnicos.. Estos tumores suelen ser pequeños (<1 cc) y de bajo grado. En un estudio de autopsia en hombres japoneses y rusos que murieron de otras causas, aproximadamente el 35% de ambos grupos tenían un cáncer de próstata, y el 50% de los hombres japoneses mayores de 70 años tenían un score de Gleason 7 o superior 130.
Los cánceres de próstata son cada vez más frecuentes en pacientes jóvenes y los beneficios de mantener la función erétil y la continencia so por supuesto mayores en los pacienets más jóvenes.
Es en este contexto nace el concepto de Vigilancia Activa, que surge como una alternativa de tratamiento de una fracción importante de pacientes con cáncer prostático. Existe consenso actualmente que en la mayoría de los pacientes con cáncer de próstata de bajo riesgo el tratamiento radical no entrega ningún beneficio significativo y el mayor riesgo es el sobretratamiento. La incorporación progresiva del manejo expectante permitió que el el grupo de trabajo de servicios preventivos de Estados Unidos (USPSTF) propuso revisar recientemente la recomendación para los hombres de 55 a 69 años para exámenes preventivos de cáncer de próstata de la categoría D (en contra) a la categoría D (neutral). (USPSFT web page).
Los pilares de la vigilancia activa son:
- Elegir adecuadamente a los pacientes con riesgo favorable.
- Seguimiento regular y riguroso del cancer prostatico mediante APE, tacto rectal, biopsias transrectal y, eventualmente imágenes.
- Ofrecer tratamiento con intención curativa ante cualquier evidencia clínica o histológica de progresión.
Actualmente un 50% de los hombres diagnosticados con CaP en USA y un 30% en Europa cumplirían criterios de bajo riesgo o de cáncer indolente 131. Sin embargo, sólo un 10% de los pacientes de bajo riesgo, y por lo tanto, candidatos a VA, son manejados con este tipo de tratamiento 132. Esto se debe principalmente al desconocimiento de esta alternativa de tratamiento por parte de médicos y pacientes. En este sentido, es importante diferenciar la VA del Watchfull Waiting (WW), ya que esta última alternativa no tiene intensión curativa, sino, dar tratamiento en caso de que aparezcan síntomas de enfermedad metastásica o de progresión local, en pacientes con expectativas de vida menor a 10-15 años 122,131.
Criterios de inclusión
Existen diversos criterios de inclusión publicados en estudios de VA. La base de los criterios de selección son las definiciones de CaP de bajo riesgo de D’Amico 133 y de CaP de muy bajo riesgo de Epstein 134: densidad APE≤ 0.15, Gleason Score ≤ 6, menos de 3 cilindros con cáncer, menos de 50% de cáncer en un cilindro. Estos criterios en algunas cohortes han sido modificados para una mejor selección de los pacientes con bajo riesgo.
Considerando que el patrón Gleason 3 tiene un escaso fenotipo metastásico la mayoría de los pacientes elegibles son aquellos con score de Gleason ≤6. Una limitante para esta estrategia es que un 25 a 30% de los pacientes diagnosticados mediante biopsia sistemática tienen un cáncer de mayor grado. Aunque la gran mayoría de estos cánceres corresponden al grupo grado 2 que también tienen un bajo potencial de metástasis la presencia de Gleason 4 se asocia a un mayor riesgo. La presencia de Gleason 3 de alto volumen es un importante marcador primario para pacientes que tienen un grado mayor de lesión histológica. Por este motivo se ha incluido en la clasificación de alguna guías clínicas, la categoría de muy bajo riesgo limitando el volumen del cáncer Gleason 3 en la biopsia. Como hemos visto, también los nomogramas han ido incorporando más elementos para estimar el volumen del cáncer.
En diferentes protocolos de vigilancia activa uno de los objetivos es indentificar si existen elementos histopatológicos mayores a Gleason 3 y una vez que esto ha sido excluído el monitoreo permite evaluar en el tiempo si esto aparece. Como hemos visto la coexistencia de un un grado mayor es común, sin embargo, la progresión de Gleson 3 a 4 ó 5 es infrecuente. En varios modelos de progresión se estima que el riesgo no es mayor al 1-2% y en la mayoría de los casos se presenta en score de Gleason 6 de alto volumen 135.
Una vez que se ha determinado que un cáncer de mayor grado no está presente es improbable que estos paciente requieran tratamiento.
En la mayoría de los protocolos los pacientes candidatos a vigilancia activa corresponden a pacientes con score de Gleason 6 y factores de muy bajo riesgo. Pacientes muy seleccionados con Gleaon 3+4 con un porcetaje bajo de patrón 4 podrían incluirse . El grupo de Toronto ha incluido en su protocolo pacientes con Gleason 3+4 con riesgo intermedio favorable y la mortalidad actuarial global reportada por cáncer de próstata a 15 años ha sido de un 5%. La mayoría de los pacientes que presentaron metástasis en el seguimeinto correspondieron a Gleason 7 136. En contraste, el protocolo del John Hopkins es más restrictivo y solo incluye pacientes con score de Gleaon 6 y que cumplan los criterios de Epstein de bajo riesgo. La mortalidad reportada por cáncer de próstata en este grupo fue de 0,5% a 15 años. Con estos criterios solo pudo incluirse un 20% de los pacientes con diagnóstico de cáncer localizado en comparación al grupo de Toronto que incluyo hasta un 50% 137. Es muy probable que la estrategia apropiada esté entre estos dos criterios. La mayoría de los pacientes con score Gleason 6 son apropiados para seguimiento activo y probablemente deban ser incluidos algunos pacientes muy seleccionados con score Gleason 7.
Recomendaciones de Manejo (Tabla 2 y 3)
Las recomendaciones presentan algunas variaciones en las diferentes guías clínicas. Los protocolos incluyen el APE cada 3 a 12 meses, el tacto rectal anual y la evaluación con resonancia magnética multiparamétrica.
Con respecto a la biopsia, las guías de NCCN y EAU recomiendan confirmar si el paciente es candidato a vigilancia activa repitiendo la biopsia dirigida por una resonancia magnética multiparamétrica y complementarla con muestras sistemáticas. Posteriormente se recomienda que dentro de los primeros 12 a 24 meses desde el diagnóstico deba realizarse una nueva biopsia para descartar cáncer de mayor riesgo que pudiera no haber sido encontrado inicialmente. Luego, debe realizarse una biopsia al año (o cada 3 a 5 años) de al menos con 12 cilindros También se recomienda biopsiar con mayor frecuencia dependiendo del TR, la cinética del APE o si la resonancia magnética sugiere una enfermedad más agresiva que la original. Ninguno de estos parámetros sin embargo, es muy confiable para detectar progresión.
Los biomarcadores no han mostrado un rol claro en los pacientes en vigilancia activa y no se consideran necesarios en la selección o seguimiento de los pacientes.
La resonancia magnética está icluida actualmente en las recomendaciones de seguimiento de los pacientes en vigilancia activa. La resonancia magnetica con biospia dirigidas a áreas sospechosas mejora significativamente la detección de cánceres de alto grado 50, aunque puede no detectar lesiones de alto grado y volumen pequeño. El valor predictivo negativo de la resonancia magnética es aproximadamente 85% lo que significa que al menos un 15% de los pacientes con un examen si lesiones sospechosas tendrán un cáncer Gleason 7 o mayor en una biopsia sistemática.
La recomendación en vigilancia activa es utilizar la resonancia magnética junto con los otros parámetros para estimar el riesgo de los pacientes y en aquellos que el riesgo de progresión es mayor, debieran programarse para biopsias sistemáticas independiente del resultado de la resonancia 138.
| EUA 2019 | NCCN 2019 | ||
| MUY BAJO | —- |
|
|
| BAJO |
|
||
| INTERMEDIO |
|
|
|
| ALTO | Localizado |
|
|
| Avanzado ó muy alto riesgo |
|
|
|
| METASTASICO | Cualquier T, N1 | HT ± docetaxel o Abi en M1 alto volumen |
|
|
Cualquier T
Cualquier N M1 |
|
||
Tabla 2. Resumen de los tratamientos recomendados por las guias clinicas de la NCCN y EAU
| Candidatos | Protocolo | |
|
AUA
2017 |
|
|
|
EAU
2019 |
|
|
|
NCCN
2019 |
|
|
EV: esperanza de vida; RMmp: Resonancia Magnética multiparamétrica
- Clinically Localized Prostate Cancer: AUA/ASTRO/SUO Guideline (2017): https://www.auanet.org/guidelines/prostate-cancer-clinically-localized-guideline#x6912
- EAU Prostate cancer guidelines (2019): https://uroweb.org/guideline/prostate-cancer/#1
- National Comprehensiva Cancer Network (NCCN) Guidelines. Prostate Cancer (version 4.2019): https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
Tabla 3. Recomendaciones para Vigilancia Activa de las Guías Clínicas AUA, EUA y NNCN
Criterios de progresión y resultados en VA
Como indicador de progresión el elemento principal es la aparicón de un patrón histológico de mayor grado de Gleason 4 o 5 (upgrading) en el seguimiento con biopsias. La gúia NCCN establece tambíen como parámetro para considerar progresión un mayor número de muestras con cáncer en la biopsia (≥3 cilindros o >50% de cáncer en algún cilindro) o una mayor extensión del cáncer en la próstata La guía de la AUA sugiere además como indicador el crecimiento de las lesiones sospechosas en la RNMmp (AUA 2017, pag 28)
En relación con el APE también se ha descrito que un tiempo de doblaje menor a 3 años podría predecir progresión. Pese a esta información, la cinética del APE, tanto la velocidad de aumento como el tiempo de doblaje, no deben ser usados como criterio de progresión por sí solos debido a su baja especificidad 24. La cinética del APE puede usarse como una guía útil para programar o adelantar la evaluación histológica.
Cuando el paciente cumple el criterio de expectativa de vida para dejar de ser candidato a tratamiento curativo, las biopsias deben descontinuarse y se mantiene en observación (watchful waiting).
De acuerdo a las distintas series publicadas, el upgrading tendría frecuencias entre 8% y 35% de los pacientes que suspenden la VA por progresión. Por su parte, el aumento del volumen del cáncer en la biopsia de seguimiento, sería responsable del 16% al 50% de las causas de progresión.
La mayor causa de mortalidad de los pacientes en vigilancia activa es cardiovascular y la mortalidad por cáncer de próstata es rara. En las series publicadas con distintos criterios de inclusión, seguimiento y progresión los resultados son similares alcanzando una sobrevida cancer específica ³95% y con una progresión a tratamiento definitivo de 30% 138. La VA mantendría libre de tratamiento activo por un promedio de 6.4 años desde el momento del diagnostico, lo que se traduce en mejor calidad de vida y reducción en los costos económicos. Existen estudios que comparan los resultados de pacientes sometidos a PR luego de progresar en su VA versus los resultados de pacientes sometidos a PR de manera inmediata y que cumplirían criterios de inclusión para VA. La mayoría de las cohortes muestra que retardar la PR no empeora los resultados 139,140, con cifras de CaP órgano-confinado entre 65% y 86% 141,142 y upgrading comparable con el de los pacientes sometidos a PR de manera inmediata 141.
Radioterapia
Radioterapia Primaria Externa (EBRT)
Se deben utilizar técnicas de RT altamente conformacionales para tratar el CaP. Las dosis de 75,6 a 79,2 Gy en fracciones convencionales a la próstata son adecuadas para pacientes con cáncer de bajo riesgo. Para pacientes con enfermedad de riesgo intermedio o alto, las dosis de hasta 81,0 Gy proporcionan un mejor control de la enfermedad 143.
Los pacientes con cáncer de alto riesgo son candidatos para irradiación de ganglios pélvicos más hormonoterapia neoadyuvante, concomitante o adyuvante por un total de 2 a 3 años. Los pacientes con cáncer de riesgo intermedio pueden ser considerados para irradiación en los ganglios linfáticos pélvicos y hormonoterapia neoadyuvante, concomitante o adyuvante de 4 a 6 meses. Los pacientes con cáncer de bajo riesgo no deben recibir irradiación en los ganglios linfáticos pélvicos ni hormonoterapia.
En la actualidad existen varios estudios randomizados que han mostrado que esquemas de hipofraccionado moderado es decir que entregan el tratamiento en menor numero de fracciones usualemente en 4 semanas es equivalente a esquemas previos de 7 a 8 semanas.
Más recientemente ha surgido la hipofraccionamiento extremo, con técnicas de alta precisión de radioterapia esterotaxica. En este caso la radiación se entrega usualmente en menos de 5 fracciones. Estudios prospectivos con miles de pacientes han mostrado excelentes resultados en pacientes de riesgo bajo e intermedio por lo que ha sido recomendado como una alternativa valida de tratamiento por guías internacionales.
Braquiterapia primaria
La braquiterapia de baja dosis (LDR) como monoterapia está indicada para pacientes con cánceres de bajo riesgo y de bajo volumen tumoral. Los cánceres de riesgo intermedio pueden ser tratados mediante la combinación de LDR con EBRT (40-50 Gy) y 4 a 6 meses de hormonoterapia 143. Los pacientes con una próstata muy grande o muy pequeña, con síntomas obstructivos o con una resección transuretral de la próstata previa son más difíciles de someter a implantes y pueden sufrir un mayor riesgo de efectos secundarios.
Más recientemente la Braquiterapia de alta tasa HDR exclusiva ha mostrado resultados equivalentes a los descritos con braquiterapia de baja tasa pero con menor toxicidad. Esta técnica es especialmente util para la sobreimpresion posterior a radioterapia externa para pacientes donde ha mostrado resultados oncologicos superiores a la radioterapia externa exclusiva.
Radioterapia Posterior a Prostatectomía
La evidencia respalda el ofrecimiento de RT adyuvante o de salvataje a la mayoría de los hombres con características patológicas adversas o APE detectable y sin evidencia de enfermedad diseminada.
Las indicaciones para la RT adyuvante incluyen enfermedad pT3, margen o márgenes quirúrgicos positivos, puntaje de Gleason 8 a 10 o compromiso de vesículas seminales 144,145. La RT adyuvante suele administrarse dentro del primer año de la cirugía y una vez que cualquier efecto quirúrgico secundario haya mejorado o se haya estabilizado. Entre las indicaciones de RT de rescate se incluyen: un APE que se vuelve detectabe y que aumenta en dos mediciones subsiguientes. Las dosis recomendads para RT adyuvante o de salvataje posterior a prostatectomía son de 64-72 Gy 146. Los estudios que han evaluado RT adyuvante versus observación demuestran un beneficio en sobrevida libre de progresión clínica o bioquímica, pero el efecto en la sobrevida libre de metástasis o sobrevida global en controvertido. La mayoría de estos estudios, corresponden a series con un número limitado de pacientes, retrospectivas o no controladas 144-149. Recientemente se ha cerrado el estudio prospectivo RADICALS, que corresponde una serie controlada y randomizada fase III que reclutó un número significativo de pacientes y uno de sus objetivos fue comparar la RT adyuvante versus RT salvataje en pacientes con un APE postoperatorio ≤0.2 ng/mL y con uno o más de los siguientes factores de alto riesgo de recurencia: pT3/4, Score de Gleason 7-10, APE preoperatorio ≥ 10 ng/mL. Aún no hay resultados publicados 150.
Entre las indicaciones para RT de rescate se incluye un APE que se vuelve detectable y que aumenta en 2 mediciones subsiguientes o APE que persisten detecables luego de la cirugia. El tratamiento es más eficaz cuando el APE previo al tratamiento es bajo y el tiempo de doblaje del APE es lento. Las dosis recomendadas para RT adyuvante o de salvataje posterior a la prostatectomía son 64–72 Gy 145. Frente a este escenario clinico el estudio realizado por Sthephenson et al., demostró que iniciar la RT de salvataje con valores de ape ≤ 0.5 ng/mL, se asocia a una menor progresión 151.
Recientemente 2 estudios randomizados publicados han mostrado beneficios en sobrevida al agregar bloqueo hormonal a la radioterapia de rescate. Los análisis de subgrupo muestran que este beneficio se concentra en aquellos con valores de antígeno mayor por lo que es importante discutir con el paciente los beneficios y efectos adversos de agregar este tratamiento.
Otras terapias para el cáncer de próstata localizado
Más allá de el seguimiento activo, la prostatectomía radical y la radioterapia, han surgidos otras terapias para el cáncer localizado que aún permancen como opciones experimentales, principalmente por su falta de seguimiento oncológico a largo plazo. Estas son principalmente la crioterpia y la terapia focal con HIFU (High-intensity focused ultrasound). Estas modalidades mínimamente invasivas tienen por objetivos reducir la toxicidad y efectos adversos en el contexto de un manejo oncológico seguro.
Sin embargo, la EUA aun recomienda estas terapias en el contexto de un estudio clínico, por lo tanto, son experimentales.
El HIFU consiste en ondas emitidas por un transductor, que causan daño tisular por efectos mecánicos y térmicos, así como por cavitación. El objetivo de HIFU es calentar tejidos malignos por encima de 65 °C. Si bien se considera una terpia minimamente invasiva y con buena recuperabilidad, las desventajas de HIFU incluyen la dificultad para lograr la ablación completa de la próstata, especialmente en las glándulas de más de 40 ml, y para tratar a los cánceres en la zona anterior de la próstata. Al igual que la criocirugía, la falta de datos comparativos prospectivos a largo plazo sobre los resultados oncológicos impide que la HIFU de la glándula completa se considere una alternativa razonable a las opciones de tratamiento curativo establecidas. Los principales efectos adversos de HIFU incluyen retención aguda de orina (10%), incontinencia urinaria (10%), disfunción eréctil (25%), dolor o sangrado rectal (11%), estenosis uretral (8%) y fístula recto-uretral (0-5%).
PET en cáncer de próstata
La tomografía por emisión de positrones (PET), es una técnica no invasiva capaz de detectar en forma tridimensional la disitribución que adopta en el organismo un cierto radiofármaco administrado en forma endovenosa. Al combinarse con el TAC es capaz de localizar anatomicaménte los focos hipercaptantes.
El marcador más usado en CaP con mejores resultados por sus mayor sensibilidad y especificidad es el PSMA (prostate specific membrane antigen). Para la detección de metástasis ganglionares tiene una sensibilidad de 64%, una especificidad de 95%, un valor predictivo positivo de 88% y un valor predictivo negativo de 82%. Para la detección de metástasis óseas los mismos porcetajes son, 98%, 100%, 100% y 98%, respectivamente. Estos valores hacen al PET PSMA muy superior al TAC y cintograma óseo para la detección de enfermedad ganglionar u ósea, respectivamente.
Indicaciones más aceptadas al día de hoy son
- Etapificación en pacientes de alto riesgo (APE 20, GS ≥ 8, pT3)
- El TAC y la RNM usan exclusivamente criterios morfológicos para definir un linfonodo como patológico, pero la mayoría de las metástasis linfáticas en cáncer de próstata son menores a 1 cm.
- El TAC tiene sensibilidad tan baja como 30% para detectar metástasis nodales.
- El PET-PSMA tiene mayor rendimiento que el TAC/RNM S: 64 vs 44%.
- En pacientes con recidiva bioquímica (APE ≥ 0.2) (es la indicación más aceptada en la literatura).
- APE entre 0.2-0.5 ng/dl tiene PET positivo en 50-60% de los casos
- A menor doblaje de APE, mayor tasa de PET (+)
En un futuro su rol se podría ampliar a la re-etapificación de los CPRC, pero faltan estudios para confirmarlo.
Linfadenectomia de rescate en paciente con recidiva ganglionar por pet
La aparición del PET ha producido un cambio en el manejo del CaP así como en otros cánceres. Se estima que el PET ha producido un cambio de conducta oncológica en el 50% de los pacientes aproximadamente. Específicamente, en relación a la recidiva bioquímica en el CaP, en que todos los pacientes iban a radioterapia habitualmente del lecho prostático, la aparición de enfermedad ganglionar en el PET ha sugerido que la linfadenectomía de rescate o la radioterapia pueden ser una opción de manejo. La revisión de la literatura reciente concluye los siguientes puntos para el manejo de estos pacientes:
- Las Imágenes incluida PET subestiman el número y ubicación de ganglios.
- Templados: La radioterapia cubre mayor territorio que la linfadenectomía incluso superextendida.
- No hay evidencia tipo 1 que avale alguna de las 2 conductas (radioterapia o cirugía) con respecto a su impacto en sobrevida.
- Sólo hay evidencia débil que mejora sobrevida libre de recurrencia bioquímica.
- La recurrencia bioquímica depende del APE al momento de la cirugía y de la ubicación y número de ganglios.
- La adición de radioterapia a la linfadenectomía mejora la recurrencia bioquímica.
- Los efectos adversos importantes son mayores en cirugía vs RT
- Los costos económicos parecen ser equivalente como tto individual, pero al optimizer el tto de RT post cirugía, ésta puede duplicar el costo.
Cancer de próstata avanzado/terapia de deprivación androgénica (tda)
CaP Avanzado (Metastásico)
Se define como TDA a cualquiera terapia que disminuya la capacidad de activar el receptor de andrógenos. Dentro de las formas de TDA está la castración que puede ser quirúrgica (orquidectomía bilateral) o médica (supresión de LH con agonistas LHRH o antagonistas GNRH) siendo ambas igualmente efectivas.
CaP hormono sensible (CPHS)
Para la enfermedad metastásica (M1) la orquidectomía bilateral o castración médica son la terapia recomendada según la guías de ASCO 2007 152.
En pacientes con enfermedad localmente avanzada (T3, T4 o N1 sin metástasis a distancia) es recomendable diferenciar los pacientes sintomáticos de los asintomáticos. En pacientes sintomáticos se debe iniciar TDA. En pacientes asintomáticos no está claro cuando es el momento ideal para iniciar TDA, debido a que la sobrevida global de estos pacientes no es diferente si la reciben precoz o tardíamente. Según la guías de ASCO 2007 no se puede hacer una recomendación para el uso de TDA temprana en este grupo de pacientes. Studer en un estudio publicado en el 2008, sugiere que los pacientes sin tratamiento (T0-T4, N0-N1, M0) con APE mayor de 50 y doblaje de antígeno menor de 12 meses tiene más probabilidad de morir de CaP por lo que se podrían beneficiar de una TDA antes de la aparición de síntomas o metástasis a distancia 153.
La TDA preferida para pacientes con enfermedad avanzada o metastásica es la castración médica o quirúrgica con o sin antiandrogenos. La terapia combinada de bloqueo androgénico, usando antiandrogenos no esteroidales, debe considerarse en los pacientes que van a iniciar TDA con agonistas de LHRH, especialmente aquellos con metástasis evidentes. La recomendación en estos casos es que el antiandrógeno debería iniciarse antes del inicio del agonista de LHRH o coadministrarse por al menos 1 semana para evitar el alza brusca de la testosterona (flare) que se observa al inicio de la terapia y que podría empeorar los síntomas 143.
En el tratamiento a largo plazo el uso combinado de castración médica o quirúrgica y antiandrógenos se asocia a un beneficio modesto entre 1-5% en la sobrevida global. Sin embargo, las guías ASCO 2007 establecen que el beneficio clínico es cuestionable al compararlo con la orquidectomía quirúrgica o medica.
La TDA intermitente es una alternativa para pacientes que tienen indicación de castración médica pero los efectos a largo plazo todavía no están claros. Estudios señalan que la terapia intermitente se asocia a mejor función sexual y menos efectos secundarios (cuando se encuentra sin terapia) que la terapia continua. Desde el punto de vista oncológico la terapia continua o intermitente tendría el mismo riesgo de progresar y de transformarse en hormono refractario 154. Sin embargo, en un estudio recientemente publicado Hussein et al. 155 demostro que la hormoterapia continua es superior a la intermitente en pctes con CaP metastasico. Sin embargo, en el subgrupo de pacientes con enfermedad metastasica extensa la hormonoterapia intermitente no fue inferior a la terapia continua 155. En estos estudios el protocolo para terapia intermitente consiste que una vez que el APE se encuentra bajo 4 y no hay progresión clínica luego de 6-9 meses de tratamiento se suspende la TDA. En caso de que el APE se eleve sobre 15-20 o se evidencia progresión clínica se debe reiniciar TDA.
Los pacientes sometidos a castración deben lograr valores de testosterona menores de 50 ng/ml según guías NCCN y EAU. Sin embargo, este corte fue definido hace varias décadas atrás cuando la medición de testosterona era menos exacta. Actualmente se ha señalado que con valores sobre 20 ng/ml aumenta el riesgo de progresar a enfermedad hormono refractaria. De manera que muchos clínicos consideran una repuesta adecuada a la castración cuando se alcanzan valores de testosterona total menores a 20 ng/ml.
Como alternativa a la castración se encuentra el uso de antiandrógenos no esteroidales como monoterapia. Sin embargo su uso en forma aislada es menos efectivo que la castración ya que tiene menor sobrevida global y mayor progresión tumoral y se asocia a ginecomastia y dolor mamario. Entre sus ventajas se encuentra que produce menos bochornos y fatiga, no produce osteoporosis y no afecta la libido o las erecciones. Dentro de los antiandrógenos no esteroidales se encuentra la flutamida y bicalutamida. Sin embargo debido a que se asocian a menor sobrevida no es la primera opción terapéutica en pacientes con CaP metastásico o avanzado.
Hoy en día y basado en múltiples estudios sugerimos enfrentar a un paciente con CPHS respondiendo las siguientes 3 preguntas:
1) Qué otra droga agregamos al terapia de deprivación androgénica?
2) Hay que tratar el tumor primario?
3) Se puede realizar terapia dirigida a las metástasis ¿ (oligometastásico)
Respuestas
1) De acuerdo a la evidencia, ya no es aceptable tratar un paciente CPHS sólo con ADT, excepto en casos de contraindicación de alguna droga o falta de cobertura a la droga.
En esta etapa hay dos estudios claves como son el CHAARTED 156 y el LATITUDE 157. CHAARTED es un estudio randomizado fase 3 donde se se randomizaron 790 hombres a ADT solo vs ADT + docetaxel. Se separaron en grupo de alto o bajo volumen nmetastásico, definido alto volumen como ≥ 4 mestastasis óseas incluyendo ≥ fuera del esqueleto axial o presencia de metástasis viscerales. El resultado fue una sobrevida 17 meses mayor en el grupo docetaxel en pacientes con alto volumen (49.2 vs 32.2 meses). No se encontró diferencia en el grupo de bajo volumen. En el estudio LATITUD 157, se analizó pacientes con CPHS de alto riesgo, es decir, tener dos de las siguiente 3 características: ≥ 3 metastasis óseas, metastasis viscerales, ≥ ISUP grado 4 157. Se randomizaron 1199 hombres, este estudió mostró disminución de mortalidad global de un 38% con el uso de abiraterona acetato + prednisona vs placebo. Este estudio luego fue actualizado y, también como el estudio CHAARTED 156, mostró una mejora de sobrevida de 17 meses 156.
Una corroboración de estos hallazgos se describen el estudio STAMPEDE 158 donde hay una mejor sobrevida incluso en pacientes de bajo riesgo usando abiraterona acetato + prednisona; y en el presente año, los estudios ENZAMET 159 y TITAN 160 muestran que tanto la Enzalutamida (160 mg/día) como la Apalutamida (240 mg/día) mejoran la sobrevida en un 33% vs los grupos placebo.
2) Sólo hay un estudio en que se demuestra que tratan el tumor primario vs solo dar tratamiento sistmeico que ayuda a responder esta pregunta. El estudio STAMPEDE muestra una mejor sobrevida libre de progresión en hombres con CPHS bajo volumen que son sometidos a Radioterpaia al primaria + tratamiento standard vs los que sometieron a tratamiento standard explusivo. No hay estudios que muestren beneficios de someter a un paciente a prostatectomia radical en pacientes oligometastásicos, o estudios que apunten además del tratamiento local el uso de otras terapias sistémicas (Abiraterona). Esa repsuesta la tendremos con los estudios en curso SWOG 1802 y PEACE 1, respectivamente.
3) La idea de tratar un paciente oligometastásico con terapia dirigida al as metástasis además de tratar el primario tiene como objetivo dilater el uso de terapia sistémica. El estudio más importante el respecto es el STOMP 161, publicado el 2018. Se trataron 62 pacientes con recurrencia por tratamiento primario y que etsaban en el escenario ologometastásico. Los pacientes con terapia dirigida ala metastasis tuvieron 21 meses libres de ADT vs los 13 meses en los que pacientes que no fueron tratados y sólo fueron seguidos.
En resumen, los pacientes con CPHS deben ser tratados no sólo con ADT, hoy hay más opciones, que pueden mejorar la sobrevida y retardar incluso el inico de terapia sistmeica como es el caso de los oligometastásicos.
CaP Resistente a la Castración (CPRC)
Se define CPRC cuando un paciente ha iniciado TDA y cumple los siguientes criterios:
-Testosterona total < 50 ng/dL y
-Elevación sucesiva de APE con valores > 2 ng/ml sobre nadir
-Con (M1) o sin (M0) metástasis demostrada.
En general el CaP con indicación de castración tiene una respuesta promedio de 2-3 años antes de volverse resistente a la castración 143. Sin embargo el rango de respuesta puede ir de meses a 10-15 años. En los pacientes con CPRC se recomienda continuar con TDA standard y mantener niveles de castración de testosterona total, ya que el cáncer en esta etapa sigue dependiendo de la estimulación androgénica y de la actividad del receptos de andrógeno. El APE ya no es un marcador confiable como en etapas más precocez, por lo que todos estos pacientes deben etapificarse periódicamente con un cintigrama óseo y al menos un TAC de pelvis.
La frecuencia depende del tiempo de doblaje del APE.
CPRC no metastásico (CPRC M0)
El CPRC no metastásico nace de 2 vías:
- Aquel paciente que sin tener enfermedad metastásica en su diagnóstico es tratado con TDA. Esto típicamente sucede en hombres añosos en que su urólogo asume una morbilidad alta para tratamiento localizado y que además no plantea wacthful waiting.
- Aquel paciente que habiendo recibido terapia curativa para el cáncer localizado, progresa bioquímicamente y comienza a recibir TDA.
Debido a que estas 2 vías se estima serán cada vez menos frecuente y con la aparición y consolidación del PET PSMA, este grupo de paciente con CPRC M0 serán cada vez menos prevalentes en el universo de hombres con CaP.
Para definir el diagnóstico y tratamiento en esta etapa se toma en cuenta la etapificación con imágenes estandar, es decir, TAC tórax, abdomen y pelvis, además de cintigrama óseo. Como se mencionó más arriba el uso del PET PSMA se ha masificado, sin embargo, aún no hay evidencia de su utilidad en esta etapa. El factor a considerar en el tratamiento de estos pacientes con CPRC M0 es el tiempo de doblaje de APE. En hombres con TDAPE > 10 meses, estos pacientes se pueden observar y no tratar hasta la aparición de metástasis o que el tiempo se haga ≤ 10 meses. Por el contratrio, en hombres con TDAPE ≤ 10 meses, deben ser tratados activamente con terapia antiandrogénica de última generación. (https://www.mskcc.org › nomograms › prostate).
Este punto de corte de 10 meses nace del estudio publicado en JCO 2013 por Smith et al 162. en que se evaluó denosumad en pacientes con CPRC M0. En este estudio el grupo placebo que no recibió denosumad y que tenía un TDAPE ≤ 10 meses tuvieron un riesgo mayor de hacer metástasis o morir por CaP.
Sólo en los últimos años se describen tratamientos que demuestre una mejoría en la sobrevida libre de metástasis en esta etapa (CPRC M0 con TDAPE ≤ 10 meses) . Es así como desde el año 2018 aparecieron las moléculas Apalutamida (SPARTAN) 163, enzalutamida (PROSPER) 164 y Darolutamida (ARAMIS) 165 como una oportunidad para estos pacientes retrasando la aparición de metástasis en 2 años. Es por esto que las las guías actualizadas al 2019 de NCCN y AUA recomiendan en estos pacientes generalmente observarlos sin el TDAPE > 10 meses o tratarlos si el TDAPE ≤ 10 meses.
Es importante mencionar que los antiandrógenos de 1ra generación (Flutamida, bicalutamida, nilutamida) no tienen rol alguno en mejorar outcomes oncológicos en estos pacientes, sólo al iniciar un antiandrogeno de 1ra generación se describe que de reduce el APE ≥ 50% en 30% de los pacientes a los pocos meses de iniciar este tratamiento 166. Lo mismo se aplica para la maniobra de suspender el uso de antiandrógenos en pacientes que se encuentren en tratamiento. Cerca de un 30% de pacientes que está con antiandrógenos presenta una disminución ≥ 50% del APE en 3 a 6 meses y en un 20% de los pacientes hasta 12 meses 167. El cambio de antiandrógeno de 1ra generación. Se reporta que 22-38% de los pacientes que estaban con flutamida al cambiarse a bicalutamida presentan una disminución del APE. El uso de ketoconazol y esteroides. Se describe una disminución ≥ 50% del APE en 50% de los pacientes que dura entre 3-8 meses. Y finalmente el uso Dietilestilbestrol (DES) en dosis de 1mg al día produce disminución del APE en hasta 43%. Esta modalidad sin embargo se ha asociado a eventos trombóticos. Todas estas drogas no tiene rol en disminuir la probablidadde metástasis o muerte por CaP. Sólo actúan disminuyendo el APE por un tiempo acotado.
La Apalutamida, de acuerdo al estudio SPARTA 168 mostró una sobrevida libre de metástasis de 40.5 meses comparado con 16.2 meses del placebo (HR 0.28, p<0.001). La enzalutamida de acuerdo al estudio PROSPER 164 mostró una sobrevida libre de metástasis de 36.6 meses comparado con 14.7 meses del placebo (HR 0.29, p<0.001). Y finalmente la Darolutamida de acuerdo al estudio ARAMIS 165, mostró una sobrevida libre de metástasis de 40.4 meses comparado con 18.4 meses del placebo (HR 0.41, p<0.001). Esto hace que estas 3 moléculas sean opciones hoy en día para un paceinte con CPRC M0 con TDAPE ≤ 10 meses.
CPRC mestastásico (CPRC M1)
Diferentes drogas han aparecido en los últimos años que han demostrado mejorar la calidad de vida y la sobrevida en pacientes con CaP, especialmente para CPRC M1. Existen alternativas para esta condición, dependiendo del volumen de enfermedad metastásica, presencia de síntomas, expectativas de vida de vida (mayor de 6 meses) y condiciones generales (ECOG).
Hasta el año 2004, la única opción de tratamiento para este grupo era Docetaxel, demostrando su eficacia en el estudio TAX-327 169, ganando una sobrevisa global de 2.4 meses vs el grupo mitoxantrone. Luego, recién el año 2010 comezaron a aparecer nuevas moléculas. Sipuleucel-T, en el estudio IMPACT 170, mostró una mejoría en sobrevida de 4.1 meses vs placebo (25.8 vs 21.7 meses). Esta droga (vacuna) es más efectiva en paciente con buena performance status y asintomaticos o levemente síntomaticos. En el estudio TROPIC 171, los pacientes ya sometidos a docetaxel, fueron randomizados a Cabazitaxel vs mitoxantrone. Lo resultados fueron de una sobrevida global 15.1 vs 12.7 meses, respectivamente (2.4 meses de diferencia). En el estudio ALSYMPCA 172, pacientes con diagnóstico de CPRC M1, con o sin docetaxel previo y exclusivamente con metástasis óseas fueron randomizados a Radio 223 vs placebo. La diferencia en sobrevida global fue 14.9 vs 11.3 meses (3.6 meses de diferencia). Además hubo un retardo en el primer evento óseo y mejor calidad de vida en el grupo Radio 223.
Las otras 2 opciones terapéuticas en el grupo de pacientes con CPRC M1 son la Abiraterona Acetato (AA) y Enzalutamida. AA es un inhibidor de la producción de testosterona que inhibe la 17α hidroxilasa, por lo tanto, bloquea la producción de testosterona a nivel de todo el organismo. Fue aprobada el 2011 por la FDA (Food and Drug Administration) para el CPRC, basado en la evidencia de mejoramiento de calidad de vida y sobrevida demostrado en los estudios randomizados post y pre Docetaxel (COU-AA 301 y COU-AA 302, respectivamente) 173,174. En el año 2017, la Acetato de Abiraterona también mostró su eficacia en pacientes sensibles a la castración de alto riesgo (≥2 de los siguientes 3 criterios: ≥3 metástasis óseas, presencia de metástasis viscerales o grupo de Gleason ≥4) en los estudios LATITUDE 157 y STAMPEDE 158, ampliando el nicho de aplicabilidad de esta molécula en paciente con CaPa. En estos estudios mostró una disminución de mortalidad por cáncer de próstata en un 38% en este grupo de pacientes.
Por lo tanto, Acetato de Abiraterona tiene rol demostrado en mejorar calidad de vida y sobrevida en 2 etapas del CaP: 1) Hormono-sensible metastásico alto riesgo, 2) Resistente a la castración M1.
En el estudio COU-AA 302 (pre docetaxel), se randomizaron 1088 pacientes a AA + prednisona vs placebo. El grupo AA mostró una mejoría en sobrevida de 5.2 meses vs placebo. En el análisis final publicado el 2014 esta direfencia definitiva fue de 4,4 meses (34,7 meses para AA vs 30,3 meses para placebo). Además todos los outcomes secundarios y en calidad de vida la AA fue superior a placebo.
En nuestro programa en Red de Salud UC/Christus, en estudio realizado 2018, comparamos a un grupo de paciente con CPRC M1 que recibieron AA vs aquellos pacientes que por divrsos motivos, principalemtne económicos no puedieron acceder a la molécula. Los resultados fueron: Sobrevida global a 2 años 52% para pacientes con tratamiento con AA vs 26% para pacientes sin AA.
En cuanto a efectos adversos, en el estudio COU-AA 302 se describió un 48% de efectos adversos grado 3-4 vs 42% en el grupo placebo y ningún paciente falleció por hepatotoxicidad. El 19% interrumpió el tratamiento habitual ya sea disminuyendo la dosis o suspendiendo la terapia.
Estos hallazgos se han replicado en nuestro programa, sólo dos pacientes han tenido que bajar dosis de Abiraterona a 750 mg por elevación de transaminasas y ninguno ha debido suspender la terapia. No hemos tenido pacientes con hipokalemia y la hipertensión se ha manejado aumentando dosis o agregando antihipertensivos.
Es importante destacar que la prednisona usada en dosis de 5 mg cada 12 horas es un reemplazo de un déficit generado en la producción de cortisol por el bloqueo de la 17 α hidroxilasa, por lo tanto, no es una sobredosis de corticoides. Sin embargo, este tema sigue siendo de debate, especialmente ahora que en el estudio LATITUDE se usó prednisona 5mg /día.
La Enzalutamida es un antiandrógeno que bloquea el receptor de andrógeno 6 veces más potente que la bicalutamida. Bloqea la dimerización del RA, su traslocación y transcripción.
En el estudio AFFIRM 175, 1199 pacientes que habían fallado a docetaxel se randomizaron a enzalutamida vs placebo. El outcome primario fue sobrevida global. La enzalutamida mostró una sobrevida global de 18.4 vs placebo de 13.6 meses (4.8 meses de diferencia). Además hubo superioridad en reducción de APE y sobrevida libre de progresión radiológica.
Luego en el estudio PREVAIL 176, se randomizaron 1717 pacientes a enzalutamida vs placebo sin docetaxel previo. El grupo enzalutamida fue superior en el outcome primario de sobrevida global HR 0.71 (29% reducción de muerte). Una actualización publicada el 2014 esta direfencia definitiva fue de 4,0 meses (35,3 meses para enzalutamida vs 31,3 meses para placebo. También la enzalutamida fue superior en outcomes secundarios y outcomes exploratorios. Los efectos adversos más frecuentes (> 20%) incluyeron fatiga, dolor de espalda, constipación, y artralgia. Los efectos adversos más característicos fueron HTA, caídas y convulsiones.
Como se mencionó más arriba la enzalutamida tambien ha mostrado rol en el CaPHS y el CPRC M0.
Mucho se ha discutido en relación a los efectos adversos relacionados con la AA y la enzalutamida y su perfil de seguridad, incluso para definir cuál sería el mejor o más adecuado tratamiento antiandrogénico de 2da generación en pacientes que se beneficiarían desde el punto de vista oncológico de su uso. Con respecto a la literatura reciente, en un meta análisis publicado recientemente se encontró que AA fue relacionado con un incremento asociado de toxicidad cardiovascular (RR: 1.28 y que enzalutamida presenta mayor riesgo de fatiga (RR: 1.29). En otro meta-análisis publicado por Zhu y col encontraron que ambas moléculas está relacionadas con efectos adversos propias y más bien particulares, hipertensión, hipokalemia y elevación pruebas hepáticas para AA, mientras que enzalutamida produce dolor lumbar, fatiga, bochornos y también hipertensión y caídas. En este estudio, COU-AA 302 se describió un 48% de efectos adversos grado 3-4 vs 42% en el grupo placebo y ningún paciente falleció por hepatotoxicidad. El 19% interrumpió el tratamiento habitual ya sea disminuyendo la dosis o suspendiendo la terapia. Los efectos derivados de los mineral corticoides fueron 22% vs 13% para HTA, 17% vs 13% para hipokalemia y 28% vs 24% para edema o retención de fluido, respectivamente para el grupo AA + prednisona 10 mg vs placebo + prednisona, respectivamente.
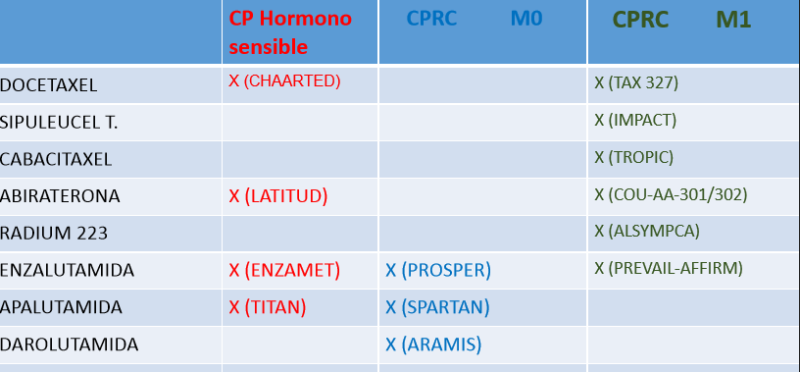

Entre paréntesis, el nombre del estudio.
Actualmente nosotros concordamos, dada nuestra experiencia que la única contraindicación absoluta del uso de AA es aquel paciente con daño hepático Child Pugh C, y que frente a pacientes con hipertensión arterial, Diabetes Mellitus y daño hepático no Child C puede ser usada de manera segura en la medida que se realice en un contexto de seguimiento y control adecuado y por médicos oncólogos y/o Urólogos que estén al día y familiarizados con el uso de esta droga.
Por último en el perfil del paciente a someterse al tratamiento con AA, debe considerarse la capacidad de adherencia y educación entregada al paciente y/o red de apoyo en relación a la posología y precauciones a seguir durante el curso del uso del AA.
Lo mismo ocurre con la enzalutamida. En nuestra experiencia es muy bien tolerada, sin embargo, se debe tener precaución especila en pacientes añosos por su perfil de efecto adverso en caídas.
Salud ósea y efectos colaterales de la TDA
La salud ósea es un tema fundamental en el paciente metastásico y/o que se encuentra en TDA.Tanto la presencia de metástasis como el uso de TDA pueden conducir a lo que llamamos un eventos esqueléticos, esto es, necesidad de radioterpia dirigida, cirugía, fractura o compresión médula espinal. Se estima que el 48% de los pacientes con Ca metastasico ósea tendrá un evento esquelito en los siguientes dos años. Es por esto que la slaud y protección ósea es fundamental y el clínico de ocuparse de este tema cuando enfrente a estos pacientes.
Denosumab y el Acido zoledrónico (bifosfonatos) previenen las complicaciones del esqueleto relacionadas con la enfermedad, entre las que se incluyen fracturas, compresión de la médula espinal o la necesidad de cirugía o RT en los huesos. Estas drogas deben prescribirse semestralmente en el caso de CPHS y mensualmente en el caso del CPRC M1.
A esto se le debe agregar vitamina D como minimo en dosis de 400 UI día. Se puede o no agregar calcio. Un ejemplo de un prescripción de sería Elcal D 500/800 una vez al día uso permanente. En un escenario ideal los paciente deben someterese a una densitometría ósea antes del inici ode la terapia e idealmente una vez al año.
Genética en cáncer de próstata y nuevas drogas en CPRC
La génetica cada vez más, tiene un rol en la progresión del cáncer de próstata y puede ser utilizada como ayuda para definir el mejor tratamiento para pacientes con cáncer avanzado.
La relación de la CaP con el ser portador del gen del cáncer de mama se descubrió de forma incidental, lo que llevó a la conclusión de que los genes hereditarios que hacen que las personas sean propensas al cáncer de ovario y / o mama también conllevan un mayor riesgo de cáncer de próstata en los hombres.
Desde el mapeo de los genes BRCA1 y BRCA2, se han publicado múltiples estudios que describen el cribado de mutaciones BRCA1 / 2, en diferentes poblaciones. En estos estudios, los pacientes pertenecientes a familias con cáncer de mama y / u ovario presentan una mutación en BRCA1 o BRCA2 en un porcentaje que varía del 10 al 50%, dependiendo de la población examinada. Estos estudios describen que los portadores de una mutación BRCA1 o BRCA2 tienen un mayor riesgo de cáncer de próstata y tienden a tener una histología tumoral más agresiva y una supervivencia más corta 177,178. BRCA2 tiene un mayor riesgo de cáncer de mama en hombres (12.5%) y riesgos acumulativos de cáncer de próstata del 18.8%, respectivamente 179.
Se prefieren tratamientos radicales para la vigilancia en pacientes recién diagnosticados, incluso en casos de bajo riesgo, y pueden identificarse temprano a través de biomarcadores genéticos que permiten clasificar la agresividad de la enfermedad. Al implementar biomarcadores, también es posible prevenir el sobretratamiento de pacientes con tumores indolentes, independientemente de los efectos adversos asociados con los tratamientos de CaP.
Los pacientes con CaP que portan una mutación BRCA2 progresan a CRPC más rápido que los no portadores, lo que puede ser un factor importante a considerar al indicar la terapia antiandrogénica. Por otro lado, se prefieren tratamientos radicales para la vigilancia en pacientes recién diagnosticados, incluso en casos de bajo riesgo, y pueden identificarse temprano a través de biomarcadores genéticos que permiten clasificar la agresividad de la enfermedad. Al implementar biomarcadores, también es posible prevenir el sobretratamiento de pacientes con tumores indolentes, independientemente de los efectos adversos asociados con los tratamientos de CaP.
Los hombres que presentan mutaciones BRCA2 serían susceptible de ser mejor tratados con inibidores PARP, como fue demostrado en el estudio del NEJM en que hombres con CPRC tratados con olaparib 400 mg dos veces día con buena respuesta y escasos efectos adversos 180.
Bibliografía
1. Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 68, 394-424 (2018).
2. Ferlay J EM, Lam F, Colombet M, Mery L, Pineros M, Znaor A, Soerjomataram I. et al. Global cancer observatory: cancer today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today, Accessed 02 February 2019. [Internet]
3. Siegel, R.L., Miller, K.D. & Jemal, A. Cancer statistics, 2018. CA Cancer J Clin 68, 7-30 (2018).
4. Ferlay J EM, Lam F, Colombet M, Mery L, Pineros M, Znaor A, Soerjomataram I. et al. Global cancer observatory: cancer today. Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today, Accessed 02 February 2019. [Internet] [Ref list].
5. Rawla, P. Epidemiology of Prostate Cancer. World J Oncol 10, 63-89 (2019).
6. Ministerio de Salud. Primer Informe de Registro Poblacionales. 2012.
7. San Francisco, I., et al. Cáncer de próstata avanzado: primer reporte de un programa especializado. Revista Chilena de Urología, 2018. 83(2). Revista Chilena de Urología 83(2018).
8. Ministerio de Salud. Guía Clínica PRÓSTATA EN PERSONAS DE 15 AÑOS Y MÁS. Minsal (2010).
9. Ministerio de Salud. Guía Clínica CANCER DE PROSTATA en personas de 15 años y más. 2010.
10. Ministerio de Salud. Serie defunciones y mortalidad por tumores malignos según sexo Chile 2000-2016.
http://www.deis.cl/wp-content/2017/gobCL-sitios-1.0/assets/SerieDefunciones_2000_2015.html, 2017.
11. Choi, E., et al. Cancer mortality-to-incidence ratio as an indicator of cancer management outcomes in Organization for Economic Cooperation and Development countries. Epidemiol Health 39, e2017006 (2017).
12. Surveillance, Epidemiology, and End Results Program. SEER Cancer Statistics Review (CSR) 1975-2012. National Cancer institute, Released April 23, 2015.
13. McGrowder, D.A., Jackson, L.A. & Crawford, T.V. Prostate cancer and metabolic syndrome: is there a link? Asian Pac J Cancer Prev 13, 1-13 (2012).
14. Prostate Cancer. EAU Guidelines 2015. Disponible en: https://uroweb.org/guideline/prostate-cancer/.
15. Nelson, P.S. Targeting the androgen receptor in prostate cancer–a resilient foe. N Engl J Med 371, 1067-1069 (2014).
16. Abouassaly R, Thompson I, Platz E, Klein E. Epidemiology, Etiology, and Pervention of Prostate Cancer. In Campbell-Walsh Urology, 10th edition 2012; pp 2704-2725
17. Epstein, J.I., Allsbrook, W.C., Jr., Amin, M.B. & Egevad, L.L. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 29, 1228-1242 (2005).
18. Harnden, P., et al. The prognostic significance of perineural invasion in prostatic cancer biopsies: a systematic review. Cancer 109, 13-24 (2007).
19. Thompson, I.M., Jr. & Leach, R. Prostate cancer and prostatic intraepithelial neoplasia: true, true, and unrelated? J Clin Oncol 31, 515-516 (2013).
20. Oesterling, J.E., et al. Serum prostate-specific antigen in a community-based population of healthy men. Establishment of age-specific reference ranges. JAMA 270, 860-864 (1993).
21. Catalona, W.J., et al. Selection of optimal prostate specific antigen cutoffs for early detection of prostate cancer: receiver operating characteristic curves. J Urol 152, 2037-2042 (1994).
22. Carter, H.B., et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA 267, 2215-2220 (1992).
23. Vickers, A.J., Till, C., Tangen, C.M., Lilja, H. & Thompson, I.M. An empirical evaluation of guidelines on prostate-specific antigen velocity in prostate cancer detection. J Natl Cancer Inst 103, 462-469 (2011).
24. Vickers, A.J., Savage, C., O’Brien, M.F. & Lilja, H. Systematic review of pretreatment prostate-specific antigen velocity and doubling time as predictors for prostate cancer. J Clin Oncol 27, 398-403 (2009).
25. Stephan, C., et al. The ratio of prostate-specific antigen (PSA) to prostate volume (PSA density) as a parameter to improve the detection of prostate carcinoma in PSA values in the range of < 4 ng/mL. Cancer 104, 993-1003 (2005).
26. Catalona, W.J., et al. Percentage of free PSA in black versus white men for detection and staging of prostate cancer: a prospective multicenter clinical trial. Urology 55, 372-376 (2000).
27. Bruzzese, D., et al. Prostate health index vs percent free prostate-specific antigen for prostate cancer detection in men with “gray” prostate-specific antigen levels at first biopsy: systematic review and meta-analysis. Transl Res 164, 444-451 (2014).
28. Fossati, N., et al. Preoperative Prostate-specific Antigen Isoform p2PSA and Its Derivatives, %p2PSA and Prostate Health Index, Predict Pathologic Outcomes in Patients Undergoing Radical Prostatectomy for Prostate Cancer: Results from a Multicentric European Prospective Study. Eur Urol 68, 132-138 (2015).
29. Carlsson, S., et al. Predictive value of four kallikrein markers for pathologically insignificant compared with aggressive prostate cancer in radical prostatectomy specimens: results from the European Randomized Study of Screening for Prostate Cancer section Rotterdam. Eur Urol 64, 693-699 (2013).
30. Stewart, G.D., et al. Clinical utility of an epigenetic assay to detect occult prostate cancer in histopathologically negative biopsies: results of the MATLOC study. J Urol 189, 1110-1116 (2013).
31. Robinson, K., et al. Accurate prediction of repeat prostate biopsy outcomes by a mitochondrial DNA deletion assay. Prostate Cancer Prostatic Dis 13, 126-131 (2010).
32. Salami, S.S., et al. Combining urinary detection of TMPRSS2:ERG and PCA3 with serum PSA to predict diagnosis of prostate cancer. Urol Oncol 31, 566-571 (2013).
33. Reid, A.H., et al. Molecular characterisation of ERG, ETV1 and PTEN gene loci identifies patients at low and high risk of death from prostate cancer. Br J Cancer 102, 678-684 (2010).
34. Cooperberg M., Simko J., Falzarano S., et al. Development and validation of the biopsy-based genomic prostate score (GPS) as a predictor of high grade or extracapsular prostate cancer to improve patient selection for active surveillance. Presented at the American Urological Association annual meeting. San Diego, CA; 2013. Abstr 2131.
35. Cuzick, J., et al. Prognostic value of an RNA expression signature derived from cell cycle proliferation genes in patients with prostate cancer: a retrospective study. Lancet Oncol 12, 245-255 (2011).
36. Karnes, R.J., et al. Validation of a genomic classifier that predicts metastasis following radical prostatectomy in an at risk patient population. J Urol 190, 2047-2053 (2013).
37. Chen, C.L., et al. Single-cell analysis of circulating tumor cells identifies cumulative expression patterns of EMT-related genes in metastatic prostate cancer. Prostate 73, 813-826 (2013).
38. Zaytoun, O.M., Moussa, A.S., Gao, T., Fareed, K. & Jones, J.S. Office based transrectal saturation biopsy improves prostate cancer detection compared to extended biopsy in the repeat biopsy population. J Urol 186, 850-854 (2011).
39. Zani, E.L., Clark, O.A. & Rodrigues Netto, N., Jr. Antibiotic prophylaxis for transrectal prostate biopsy. Cochrane Database Syst Rev, CD006576 (2011).
40. Hodge, K.K., McNeal, J.E., Terris, M.K. & Stamey, T.A. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 142, 71-74; discussion 74-75 (1989).
41. Nash, P.A., Bruce, J.E., Indudhara, R. & Shinohara, K. Transrectal ultrasound guided prostatic nerve blockade eases systematic needle biopsy of the prostate. J Urol 155, 607-609 (1996).
42. Presti, J.C. Prostate biopsy: current status and limitations. Rev Urol 9, 93-98 (2007).
43. Tombal, B., et al. Does site-specific labelling and individual processing of sextant biopsies improve the accuracy of prostate biopsy in predicting pathological stage in patients with T1c prostate cancer? BJU Int 89, 543-548 (2002).
44. Bjurlin, M.A., et al. Optimization of initial prostate biopsy in clinical practice: sampling, labeling and specimen processing. J Urol 189, 2039-2046 (2013).
45. Serefoglu, E.C., et al. How reliable is 12-core prostate biopsy procedure in the detection of prostate cancer? Can Urol Assoc J 7, E293-298 (2013).
46. Bjurlin, M.A., Wysock, J.S. & Taneja, S.S. Optimization of prostate biopsy: review of technique and complications. Urol Clin North Am 41, 299-313 (2014).
47. Marks, L., Young, S. & Natarajan, S. MRI-ultrasound fusion for guidance of targeted prostate biopsy. Curr Opin Urol 23, 43-50 (2013).
48. Namekawa, T., et al. Prospective evaluation of the safety of transrectal ultrasound-guided transperineal prostate biopsy based on adverse events. Int J Clin Oncol 20, 1185-1191 (2015).
49. Mottet, N., et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol 71, 618-629 (2017).
50. Ahmed, H.U., et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 389, 815-822 (2017).
51. Zhao, C., et al. The efficiency of multiparametric magnetic resonance imaging (mpMRI) using PI-RADS Version 2 in the diagnosis of clinically significant prostate cancer. Clin Imaging 40, 885-888 (2016).
52. Bjurlin, M.A., et al. Update of the Standard Operating Procedure on the Use of Multiparametric Magnetic Resonance Imaging for the Diagnosis, Staging and Management of Prostate Cancer. J Urol 203, 706-712 (2020).
53. Kasivisvanathan, V., et al. MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. N Engl J Med 378, 1767-1777 (2018).
54. Wise, J. NICE recommends MRI for suspected prostate cancer to reduce biopsies. BMJ 363, k5290 (2018).
55. Schouten, M.G., et al. Why and Where do We Miss Significant Prostate Cancer with Multi-parametric Magnetic Resonance Imaging followed by Magnetic Resonance-guided and Transrectal Ultrasound-guided Biopsy in Biopsy-naive Men? Eur Urol 71, 896-903 (2017).
56. Siddiqui, M.M., et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer. JAMA 313, 390-397 (2015).
57. Fulgham, P.F., et al. AUA Policy Statement on the Use of Multiparametric Magnetic Resonance Imaging in the Diagnosis, Staging and Management of Prostate Cancer. J Urol 198, 832-838 (2017).
58. Valerio, M., et al. Detection of Clinically Significant Prostate Cancer Using Magnetic Resonance Imaging-Ultrasound Fusion Targeted Biopsy: A Systematic Review. Eur Urol 68, 8-19 (2015).
59. Delongchamps, N.B., et al. Prebiopsy magnetic resonance imaging and prostate cancer detection: comparison of random and targeted biopsies. J Urol 189, 493-499 (2013).
60. Wegelin, O., et al. The FUTURE Trial: A Multicenter Randomised Controlled Trial on Target Biopsy Techniques Based on Magnetic Resonance Imaging in the Diagnosis of Prostate Cancer in Patients with Prior Negative Biopsies. Eur Urol 75, 582-590 (2019).
61. Hamdy, F.C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375, 1415-1424 (2016).
62. Epstein, J.I., et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 40, 244-252 (2016).
63. Ham, W.S., et al. New Prostate Cancer Grading System Predicts Long-term Survival Following Surgery for Gleason Score 8-10 Prostate Cancer. Eur Urol 71, 907-912 (2017).
64. Loeb, S., et al. Evaluation of the 2015 Gleason Grade Groups in a Nationwide Population-based Cohort. Eur Urol 69, 1135-1141 (2016).
65. Epstein, J.I., et al. A Contemporary Prostate Cancer Grading System: A Validated Alternative to the Gleason Score. Eur Urol 69, 428-435 (2016).
66. He, J., et al. Validation of a Contemporary Five-tiered Gleason Grade Grouping Using Population-based Data. Eur Urol 71, 760-763 (2017).
67. Leapman, M.S., et al. Application of a Prognostic Gleason Grade Grouping System to Assess Distant Prostate Cancer Outcomes. Eur Urol 71, 750-759 (2017).
68. Pompe, R.S., et al. Population-Based Validation of the 2014 ISUP Gleason Grade Groups in Patients Treated With Radical Prostatectomy, Brachytherapy, External Beam Radiation, or no Local Treatment. Prostate 77, 686-693 (2017).
69. Gandaglia, G., et al. Are all grade group 4 prostate cancers created equal? Implications for the applicability of the novel grade grouping. Urol Oncol 35, 461 e467-461 e414 (2017).
70. Muralidhar, V., et al. Definition and Validation of “Favorable High-Risk Prostate Cancer”: Implications for Personalizing Treatment of Radiation-Managed Patients. Int J Radiat Oncol Biol Phys 93, 828-835 (2015).
71. Pollard, M.E., et al. Heterogeneity of Outcomes in D’Amico Intermediate-Risk Prostate Cancer Patients after Radical Prostatectomy: Influence of Primary and Secondary Gleason Score. Oncol Res Treat 40, 508-514 (2017).
72. Dinh, K.T., et al. Incidence and Predictors of Upgrading and Up Staging among 10,000 Contemporary Patients with Low Risk Prostate Cancer. J Urol 194, 343-349 (2015).
73. Kattan, M.W., et al. American Joint Committee on Cancer acceptance criteria for inclusion of risk models for individualized prognosis in the practice of precision medicine. CA Cancer J Clin 66, 370-374 (2016).
74. Thompson, I.M., Jr., Leach, R.J. & Ankerst, D.P. Focusing PSA testing on detection of high-risk prostate cancers by incorporating patient preferences into decision making. JAMA 312, 995-996 (2014).
75. Cooperberg, M.R., Broering, J.M. & Carroll, P.R. Risk assessment for prostate cancer metastasis and mortality at the time of diagnosis. J Natl Cancer Inst 101, 878-887 (2009).
76. Cooperberg, M.R., Hilton, J.F. & Carroll, P.R. The CAPRA-S score: A straightforward tool for improved prediction of outcomes after radical prostatectomy. Cancer 117, 5039-5046 (2011).
77. Brajtbord, J.S., Leapman, M.S. & Cooperberg, M.R. The CAPRA Score at 10 Years: Contemporary Perspectives and Analysis of Supporting Studies. Eur Urol 71, 705-709 (2017).
78. Zimmermann, M., et al. CAPRA-S predicts outcome for adjuvant and salvage external beam radiotherapy after radical prostatectomy. Can Urol Assoc J 10, 132-136 (2016).
79. Briganti, A., et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 61, 480-487 (2012).
80. Gandaglia, G., et al. Development and Internal Validation of a Novel Model to Identify the Candidates for Extended Pelvic Lymph Node Dissection in Prostate Cancer. Eur Urol 72, 632-640 (2017).
81. Huang, C., et al. Preoperative PI-RADS Version 2 scores helps improve accuracy of clinical nomograms for predicting pelvic lymph node metastasis at radical prostatectomy. Prostate Cancer Prostatic Dis 23, 116-126 (2020).
82. Gandaglia, G., et al. A Novel Nomogram to Identify Candidates for Extended Pelvic Lymph Node Dissection Among Patients with Clinically Localized Prostate Cancer Diagnosed with Magnetic Resonance Imaging-targeted and Systematic Biopsies. Eur Urol 75, 506-514 (2019).
83. Dalela, D., Loppenberg, B., Sood, A., Sammon, J. & Abdollah, F. Contemporary Role of the Decipher(R) Test in Prostate Cancer Management: Current Practice and Future Perspectives. Rev Urol 18, 1-9 (2016).
84. Furusato, B., et al. Do patients with low volume prostate cancer have prostate specific antigen recurrence following radical prostatectomy? J Clin Pathol 61, 1038-1040 (2008).
85. Lee, A.K. & D’Amico, A.V. Utility of prostate-specific antigen kinetics in addition to clinical factors in the selection of patients for salvage local therapy. J Clin Oncol 23, 8192-8197 (2005).
86. Pound, C.R., et al. Natural history of progression after PSA elevation following radical prostatectomy. JAMA 281, 1591-1597 (1999).
87. Holmberg, L., et al. Results from the Scandinavian Prostate Cancer Group Trial Number 4: a randomized controlled trial of radical prostatectomy versus watchful waiting. J Natl Cancer Inst Monogr 2012, 230-233 (2012).
88. Wilt, T.J., et al. Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377, 132-142 (2017).
89. Cheng, J.Y. The Prostate Cancer Intervention Versus Observation Trial (PIVOT) in Perspective. J Clin Med Res 5, 266-268 (2013).
90. Hoffman, R.M., et al. Mortality after radical prostatectomy or external beam radiotherapy for localized prostate cancer. J Natl Cancer Inst 105, 711-718 (2013).
91. Nepple, K.G., et al. Mortality after prostate cancer treatment with radical prostatectomy, external-beam radiation therapy, or brachytherapy in men without comorbidity. Eur Urol 64, 372-378 (2013).
92. Wiegel, T., Stockle, M. & Bartkowiak, D. PREFEREnce-based randomized evaluation of treatment modalities in low or early intermediate-risk prostate cancer. Eur Urol 67, 1-2 (2015).
93. Robertson, C., et al. Relative effectiveness of robot-assisted and standard laparoscopic prostatectomy as alternatives to open radical prostatectomy for treatment of localised prostate cancer: a systematic review and mixed treatment comparison meta-analysis. BJU Int 112, 798-812 (2013).
94. Binder, J. & Kramer, W. Robotically-assisted laparoscopic radical prostatectomy. BJU Int 87, 408-410 (2001).
95. Cao, L., Yang, Z., Qi, L. & Chen, M. Robot-assisted and laparoscopic vs open radical prostatectomy in clinically localized prostate cancer: perioperative, functional, and oncological outcomes: A Systematic review and meta-analysis. Medicine (Baltimore) 98, e15770 (2019).
96. Du, Y., et al. Robot-Assisted Radical Prostatectomy Is More Beneficial for Prostate Cancer Patients: A System Review and Meta-Analysis. Med Sci Monit 24, 272-287 (2018).
97. Ilic, D., et al. Laparoscopic and robot-assisted vs open radical prostatectomy for the treatment of localized prostate cancer: a Cochrane systematic review. BJU Int 121, 845-853 (2018).
98. Eggener, S.E., et al. Radical prostatectomy shortly after prostate biopsy does not affect operative difficulty or efficacy. Urology 69, 1128-1133 (2007).
99. Martin, G.L., et al. Interval from prostate biopsy to robot-assisted radical prostatectomy: effects on perioperative outcomes. BJU Int 104, 1734-1737 (2009).
100. Park, B., et al. Interval from prostate biopsy to radical prostatectomy does not affect immediate operative outcomes for open or minimally invasive approach. J Korean Med Sci 29, 1688-1693 (2014).
101. Meunier, M.E., et al. [Does the delay from prostate biopsy to radical prostatectomy influence the risk of biochemical recurrence?]. Prog Urol 28, 475-481 (2018).
102. Myers, R.P. Improving the exposure of the prostate in radical retropubic prostatectomy: longitudinal bunching of the deep venous plexus. J Urol 142, 1282-1284 (1989).
103. Schlomm, T., et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reduces positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol 62, 333-340 (2012).
104. Schoeppler, G.M., et al. The impact of bladder neck mucosal eversion during open radical prostatectomy on bladder neck stricture and urinary extravasation. Int Urol Nephrol 44, 1403-1410 (2012).
105. Rocco, B., et al. Posterior musculofascial reconstruction after radical prostatectomy: a systematic review of the literature. Eur Urol 62, 779-790 (2012).
106. Suardi, N., et al. Indication for and extension of pelvic lymph node dissection during robot-assisted radical prostatectomy: an analysis of five European institutions. Eur Urol 66, 635-643 (2014).
107. Fossati, N., et al. The Benefits and Harms of Different Extents of Lymph Node Dissection During Radical Prostatectomy for Prostate Cancer: A Systematic Review. Eur Urol 72, 84-109 (2017).
108. Munbauhal, G., et al. Current perspectives of sentinel lymph node dissection at the time of radical surgery for prostate cancer. Cancer Treat Rev 50, 228-239 (2016).
109. Van den Bergh, L., et al. Reliability of sentinel node procedure for lymph node staging in prostate cancer patients at high risk for lymph node involvement. Acta Oncol 54, 896-902 (2015).
110. Wilt, T.J., et al. Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367, 203-213 (2012).
111. Mattei, A., et al. The template of the primary lymphatic landing sites of the prostate should be revisited: results of a multimodality mapping study. Eur Urol 53, 118-125 (2008).
112. Abdollah, F., et al. Impact of adjuvant radiotherapy on survival of patients with node-positive prostate cancer. J Clin Oncol 32, 3939-3947 (2014).
113. Messing, E.M., et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 7, 472-479 (2006).
114. Touijer, K.A., et al. Survival Outcomes of Men with Lymph Node-positive Prostate Cancer After Radical Prostatectomy: A Comparative Analysis of Different Postoperative Management Strategies. Eur Urol 73, 890-896 (2018).
115. Schiavina, R., et al. The extent of pelvic lymph node dissection correlates with the biochemical recurrence rate in patients with intermediate- and high-risk prostate cancer. BJU Int 108, 1262-1268 (2011).
116. Abdollah, F., et al. More extensive pelvic lymph node dissection improves survival in patients with node-positive prostate cancer. Eur Urol 67, 212-219 (2015).
117. Fossati, N., et al. More Extensive Lymph Node Dissection at Radical Prostatectomy is Associated with Improved Outcomes with Salvage Radiotherapy for Rising Prostate-specific Antigen After Surgery: A Long-term, Multi-institutional Analysis. Eur Urol 74, 134-137 (2018).
118. Abdollah, F., et al. A critical assessment of the value of lymph node dissection at radical prostatectomy: A population-based study. Prostate 71, 1587-1594 (2011).
119. Miyake, H., et al. Quantitative detection of micrometastases in pelvic lymph nodes in patients with clinically localized prostate cancer by real-time reverse transcriptase-PCR. Clin Cancer Res 13, 1192-1197 (2007).
120. Fujimoto, N., Shiota, M., Tomisaki, I., Minato, A. & Yahara, K. Reconsideration on Clinical Benefit of Pelvic Lymph Node Dissection during Radical Prostatectomy for Clinically Localized Prostate Cancer. Urol Int 103, 125-136 (2019).
121. Prodocimo J, Guglimelmetti G, Pontes J, et al. Extended versus limited pelvic lymphadenectomy during radical prostatectomy for intermediate-and high-risk prostate cancer: Early outcomes from a randomizad controlled phase III study. ClinicalTrials.gov NCT01812902. Presented at the ASCO Annual Meeting 2017 chicago, USA
122. Klotz, L. Active surveillance for prostate cancer: overview and update. Curr Treat Options Oncol 14, 97-108 (2013).
123. Hanahan, D. & Weinberg, R.A. Hallmarks of cancer: the next generation. Cell 144, 646-674 (2011).
124. Ross, H.M., et al. Do adenocarcinomas of the prostate with Gleason score (GS) </=6 have the potential to metastasize to lymph nodes? Am J Surg Pathol 36, 1346-1352 (2012).
125. Alemozaffar, M., et al. Prediction of erectile function following treatment for prostate cancer. JAMA 306, 1205-1214 (2011).
126. Talcott, J.A., et al. Patient-reported symptoms after primary therapy for early prostate cancer: results of a prospective cohort study. J Clin Oncol 16, 275-283 (1998).
127. van den Bergh, R.C., et al. Is delayed radical prostatectomy in men with low-risk screen-detected prostate cancer associated with a higher risk of unfavorable outcomes? Cancer 116, 1281-1290 (2010).
128. Wit, E.M.K., et al. Sentinel Node Procedure in Prostate Cancer: A Systematic Review to Assess Diagnostic Accuracy. Eur Urol 71, 596-605 (2017).
129. Sakr, W.A., et al. High grade prostatic intraepithelial neoplasia (HGPIN) and prostatic adenocarcinoma between the ages of 20-69: an autopsy study of 249 cases. In Vivo 8, 439-443 (1994).
130. Zlotta, A.R., et al. Prevalence of prostate cancer on autopsy: cross-sectional study on unscreened Caucasian and Asian men. J Natl Cancer Inst 105, 1050-1058 (2013).
131. Eggener, S.E., et al. A multi-institutional evaluation of active surveillance for low risk prostate cancer. J Urol 189, S19-25; discussion S25 (2013).
132. Ganz, P.A., et al. National Institutes of Health State-of-the-Science Conference: role of active surveillance in the management of men with localized prostate cancer. Ann Intern Med 156, 591-595 (2012).
133. D’Amico, A.V., et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 280, 969-974 (1998).
134. Epstein, J.I., Walsh, P.C., Carmichael, M. & Brendler, C.B. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 271, 368-374 (1994).
135. Ku, J.H., et al. Biochemical recurrence after radical prostatectomy with or without pelvic lymphadenectomy in Korean men with high-risk prostate cancer. Jpn J Clin Oncol 41, 656-662 (2011).
136. Klotz, L., et al. Long-term follow-up of a large active surveillance cohort of patients with prostate cancer. J Clin Oncol 33, 272-277 (2015).
137. Tosoian, J.J., et al. Intermediate and Longer-Term Outcomes From a Prospective Active-Surveillance Program for Favorable-Risk Prostate Cancer. J Clin Oncol 33, 3379-3385 (2015).
138. Klotz, L. Contemporary approach to active surveillance for favorable risk prostate cancer. Asian J Urol 6, 146-152 (2019).
139. Bangma, C.H., et al. Active surveillance for low-risk prostate cancer. Crit Rev Oncol Hematol 85, 295-302 (2013).
140. Satkunasivam, R., et al. Pathological, oncologic and functional outcomes of radical prostatectomy following active surveillance. J Urol 190, 91-95 (2013).
141. Bul, M., et al. Radical prostatectomy for low-risk prostate cancer following initial active surveillance: results from a prospective observational study. Eur Urol 62, 195-200 (2012).
142. Klotz, L. Active surveillance for low-risk prostate cancer. F1000 Med Rep 4, 16 (2012).
143. National Comprehensive Cancer Network. NCCN Guidelines. Prostate Cancer 2015. Disponible en: http://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf.
144. Swanson, G.P., et al. Update of SWOG 8794: Adjuvant Radiotherapy for pT3 Prostate Cancer Improves Metastasis Free Survival. Int J Radiat Oncol Biol Phys 72, S31 (2008).
145. Thompson, I.M., et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181, 956-962 (2009).
146. Van der Kwast, T.H., et al. Identification of patients with prostate cancer who benefit from immediate postoperative radiotherapy: EORTC 22911. J Clin Oncol 25, 4178-4186 (2007).
147. Bolla, M., et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 366, 572-578 (2005).
148. Pasquier, D. & Ballereau, C. Adjuvant and salvage radiotherapy after prostatectomy for prostate cancer: a literature review. Int J Radiat Oncol Biol Phys 72, 972-979 (2008).
149. Wiegel, T., et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 27, 2924-2930 (2009).
150. Parker, C., et al. RADICALS (Radiotherapy and Androgen Deprivation in Combination after Local Surgery). Clin Oncol (R Coll Radiol) 19, 167-171 (2007).
151. Stephenson, A.J., et al. Predicting the outcome of salvage radiation therapy for recurrent prostate cancer after radical prostatectomy. J Clin Oncol 25, 2035-2041 (2007).
152. Loblaw, D.A., et al. Initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer: 2006 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol 25, 1596-1605 (2007).
153. Studer, U.E., et al. Using PSA to guide timing of androgen deprivation in patients with T0-4 N0-2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 53, 941-949 (2008).
154. Botrel, T.E., et al. Intermittent versus continuous androgen deprivation for locally advanced, recurrent or metastatic prostate cancer: a systematic review and meta-analysis. BMC Urol 14, 9 (2014).
155. Hussain, M., et al. Intermittent versus continuous androgen deprivation in prostate cancer. N Engl J Med 368, 1314-1325 (2013).
156. Sweeney, C.J., et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med 373, 737-746 (2015).
157. Fizazi, K., et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 377, 352-360 (2017).
158. James, N.D., Spears, M.R. & Sydes, M.R. Abiraterone in Metastatic Prostate Cancer. N Engl J Med 377, 1696-1697 (2017).
159. Davis, I.D., et al. Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer. N Engl J Med 381, 121-131 (2019).
160. Chi, K.N., et al. Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 381, 13-24 (2019).
161. Ost, P., et al. Surveillance or Metastasis-Directed Therapy for Oligometastatic Prostate Cancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J Clin Oncol 36, 446-453 (2018).
162. Smith, M.R., et al. Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer: exploratory analyses by baseline prostate-specific antigen doubling time. J Clin Oncol 31, 3800-3806 (2013).
163. Smith, M.R., Yu, M.K. & Small, E.J. Apalutamide and Metastasis-free Survival in Prostate Cancer. N Engl J Med 378, 2542 (2018).
164. Hussain, M., Saad, F. & Sternberg, C.N. Enzalutamide in Castration-Resistant Prostate Cancer. N Engl J Med 379, 1381 (2018).
165. Fizazi, K., et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 380, 1235-1246 (2019).
166. Chang, S.S. Treatment options for hormone-refractory prostate cancer. Rev Urol 9 Suppl 2, S13-18 (2007).
167. Sartor, A.O., et al. Antiandrogen withdrawal in castrate-refractory prostate cancer: a Southwest Oncology Group trial (SWOG 9426). Cancer 112, 2393-2400 (2008).
168. Smith, M.R., et al. Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 378, 1408-1418 (2018).
169. Petrylak, D.P., et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 351, 1513-1520 (2004).
170. Kantoff, P.W., et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 363, 411-422 (2010).
171. de Bono, J.S., et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 376, 1147-1154 (2010).
172. Parker, C., et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369, 213-223 (2013).
173. de Bono, J.S., et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 364, 1995-2005 (2011).
174. Ryan, C.J., et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 368, 138-148 (2013).
175. Scher, H.I., et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 367, 1187-1197 (2012).
176. Beer, T.M., et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 371, 424-433 (2014).
177. Nyberg, T., et al. Prostate Cancer Risks for Male BRCA1 and BRCA2 Mutation Carriers: A Prospective Cohort Study. Eur Urol 77, 24-35 (2020).
178. Page, E.C., et al. Interim Results from the IMPACT Study: Evidence for Prostate-specific Antigen Screening in BRCA2 Mutation Carriers. Eur Urol 76, 831-842 (2019).
179. Roed Nielsen, H., Petersen, J., Therkildsen, C., Skytte, A.B. & Nilbert, M. Increased risk of male cancer and identification of a potential prostate cancer cluster region in BRCA2. Acta Oncol 55, 38-44 (2016).
180. Mateo, J., et al. DNA-Repair Defects and Olaparib in Metastatic Prostate Cancer. N Engl J Med 373, 1697-1708 (2015).
