Capítulo 24
Cáncer de vía urinaria alta
- Mario Fernández A., Hugo Bermúdez L., Hugo Otaola A., Alfred Krebs P.
- Clínica Alemana de Santiago – Universidad del Desarrollo
Epidemiología
El cáncer de vía urinaria alta (CVUA) es considerado una neoplasia de rara ocurrencia. Los tumores de pelvis renal constituyen alrededor del 10% de los tumores renales y menos del 5% de los tumores uroteliales. Los tumores ureterales por su parte se presentan aún con menos frecuencia, con una relación de 1:4 con respecto a los tumores de pelvis renal. La incidencia global del CVUA es difícil de precisar debido a que los registros poblacionales frecuentemente no han diferenciado esta entidad de otros tumores renales. Sin embargo, se estima en 1-2/100.000 habitantes1.
En Chile existen cifras precisas a partir de tres registros poblacionales de cáncer – Antofagasta, Biobío y Los Ríos. En ellos, la incidencia varía entre 0,2 a 1,6/100.000 en hombres y 0,1 a 0,9/100.000 en mujeres, siendo significativamente más elevada en Antofagasta2,3. Asimismo, al igual que en las cifras globales, los hombres son más afectados que las mujeres con una proporción de 2:1.
La incidencia del CVUA ha presentado un leve aumento en las últimas décadas como consecuencia de la introducción de mejores métodos diagnósticos con imágenes axiales y técnicas endoscópicas, además del aumento de la expectativa de vida, tomando en cuenta que la mayor cantidad de CVUA se presenta en la octava y novena década de la vida1.
Otra razón relevante para este aumento de incidencia es también la mayor sobrevida de pacientes con cáncer de vejiga. La importancia de lo anterior se basa en que en hasta el 15% del CVUA existe un cáncer de vejiga simultáneo y que entre el 20 y 50% desarrolla una recidiva intravesical en el seguimiento4. Sin embargo, el CVUA se presenta en hasta un 60% con un patrón invasor (T2) a diferencia de solamente un 15-25% del cáncer de vejiga. Por otro lado, entre 1 y 6% de los pacientes tratados con cistectomía radical presentan un CVUA en el seguimiento, la mayoría de ellos antes de 5 años4,5.
Etiología y factores de riesgo
Existen numerosos factores etiológicos en el CVUA, tanto hereditarios como ambientales. Gran parte de ellos son similares al cáncer de vejiga, sin embargo existen algunos específicos para el CVUA.
El factor ambiental más relevante, al igual que en vejiga, es el tabaquismo, presente en aproximadamente el 65% de los casos, elevando el riesgo entre 2,5 y 7 veces6. Este riesgo es dosis-dependiente, teniendo también un significativo impacto en pronóstico, con desenlaces inferiores7. Por otro lado, la disminución del riesgo con la cesación del hábito es incierta.
La nefropatía por ácido aristolóquico se asocia de manera significativa y específica al desarrollo de CVUA mediante mutaciones del gen p53, con un riesgo estimado de 50-100 veces. Esta etiología es común a distintos fenómenos epidemiológicos del CVUA asociados a ingesta de distintos vegetales conteniendo este tóxico, siendo más relevante en el Danubio oriental en Europa a partir del consumo de semillas presentes en la cosecha de trigo (Nefropatía de los Balcanes) y en Asia (China y Taiwán) a partir del consumo de hierbas medicinales con el mismo tóxico8.
Las aminas aromáticas, presentes históricamente en la industria textil, carbonífera, química y de plásticos, han sido relacionadas de manera consistente con el CVUA, con un riesgo estimado (OR) de 8 luego de al menos 7 años de exposición9. La latencia hasta el desarrollo de la enfermedad es de aproximadamente 20 años. La relevancia de esta exposición laboral ha ido decayendo en los últimos 40 años como consecuencia de diversas medidas de protección en los lugares de trabajo9.
Desde el punto de vista genético, se han identificado dos polimorfismos asociados de manera significativa a la ocurrencia de la enfermedad, específicamente en enzimas involucradas en el metabolismo de carcinógenos asociados10. Por otro lado, la variante familiar del CVUA se asocia al cáncer colorrectal hereditario no asociado a poliposis, también conocido como Síndrome de Lynch, causado por mutaciones en genes de mecanismos de reparación de ADN (Mismatch repair). Debe sospecharse en pacientes <60 años al momento del diagnóstico, o bien en caso de antecedentes personales o familiares de algún tumor del espectro del síndrome (colon, endometrio, estómago, ovario, etc.)11.
Finalmente, y muy relevante en nuestro país, la exposición a arsénico constituye también un significativo factor de riesgo para el desarrollo de CVUA. Inicialmente observado en Taiwán (pero con el confundente de la enfermedad del pie negro, endémica en la isla12), es sin embargo en Antofagasta donde es evidente una asociación. De las 257 muertes por CVUA en Chile entre 1990 y 2016; 81 (34%) ocurrieron en Antofagasta, donde vive solamente el 3.5% de la población del país, siendo de esta manera 17 veces más elevada en esta región13. De esta manera, es mandatorio incorporar este antecedente en la evaluación de pacientes con sospecha de cáncer de urotelio.
Clasificación
La morfología del CVUA es equivalente al del cáncer de vejiga, siendo más del 95% de origen urotelial. De esta manera, está incluida en la clasificación OMS para tumores del tracto urotelial del año 2016, la cual ha sido adoptada por las sociedades científicas más importantes como el estándar14. Dentro de las ventajas destacan la terminología uniforme con criterios detallados para condiciones preneoplásicas y grados tumorales. Desde el punto de vista clínico se confirma la eliminación de categorias ambiguas del sistema OMS de 1973 (grado 1 a 2; grado 2 a 3)15.
La clasificación reconoce neoplasias uroteliales no invasoras (carcinoma in situ urotelial, carcinoma papilar urotelial no invasor de bajo grado, carcinoma papilar urotelial de alto grado, neoplasia urotelial de bajo potencial maligno, papiloma urotelial, papiloma urotelial invertido, proliferación urotelial de potencial maligno incierto y displasia urotelial) y el carcinoma urotelial infiltrante. Éste último se asocia en aproximadamente un 25% a variantes histológicas (adenocarcinoma, células escamosas, escamoso, micropapilar, células pequeñas, etc.). Al igual que en cáncer de vejiga, en general confieren un pronóstico desfavorable.
La etapificación del CVUA está basada en el sistema TNM, que a su vez clasifica el CVUA en seis grupos pronósticos (Tablas 1 y 2)16.
| T – Tumor primario | |
| TX | Tumor primario no puede ser evaluado |
| T0 | Sin evidencia de tumor primario |
| Ta | Carcinoma papilar no invasor |
| Tis | Carcinoma in situ (tumor plano) |
| T1 | Tumor infiltra tejido subepitelial |
| T2 | Tumor infiltra músculo |
| T3 | Tumor infiltra tejido graso peripiélico o parénquima renal (pelvis renal) o grasa periureteral (uréter) |
| T4 | Tumor infiltra órganos adyacentes o grasa perirrenal más allá de parénquima renal |
| N – Linfonodos regionales | |
| NX | Linfonodos regionales no pueden ser evaluados |
| N0 | Sin evidencia de Linfonodos regionales |
| N1 | Metástasis solitaria en linfonodo de 2cm |
| N2 | Metástasis solitaria linfonodo > 2cm o bien múltiple |
| M – Metástasis a distancia | |
| M0 | Sin metástasis a distancia |
| M1 | Metástasis a distancia |
Tabla 1. TNM del Cáncer de Vía Urinaria Alta (2016)
| Etapa 0a | Ta N0 M0 |
| Etapa 0is | Tis N0 M0 |
| Etapa I | T1 N0 M0 |
| Etapa II | T2 N0 M0 |
| Etapa III | T3 N0 M0 |
| Etapa IV |
T4 N0 M0
Tx N1/2 M0 Tx Nx M1 |
Tabla 2. Etapas de la AJCC
Presentación clínica
Síntomas
El síntoma más frecuente es la hematuria (60-80% de casos), asociándose otras manifestaciones clínicas (dolor en flanco, anorexia, pérdida de peso) en general a enfermedad más avanzada. Por otro lado, entre 15 a 33% de los casos se presenta como un diagnóstico incidental, si bien <1% de los casos de hematuria corresponden a CVUA17,18.
Estudio diagnóstico
El diagnóstico del CVUA se basa en una combinación de exámenes de laboratorio (función renal y hemograma como mínimo), imágenes y evaluaciones endoscópicas con o sin citología urinaria y/o marcadores tumorales. Estas herramientas juegan un rol clave en la estratificación de riesgo y también en la decisión terapéutica.
La urografía por tomografía computarizada (TC) – Uro TAC en nuestro país – es actualmente la técnica de imagen más precisa para el diagnóstico del CVUA, siendo de esta manera considerada como el estándar (Figuras 1 y 2)19. La TC puede ayudar además a predecir la etapa T del tumor primario (precisión hasta del 88%), siendo útil en la detección de metástasis regionales y a distancia (para esto último debe incluirse siempre una TC de Tórax)20. Sin embargo, presenta deficiencias en la detección de lesiones planas y tumores <3mm (hasta 40% de sensibilidad), casos en los cuales habitualmente es necesaria una evaluación endoscópica complementaria21. La TC con emisión de positrones (PET) constituye una alternativa promisoria para la evaluación de metástasis a distancia, con una sensibilidad superior a la TC convencional en estudios iniciales (85 vs. 50%), sin embargo requiere más validación para recomendar su uso rutinario en el estudio del CVUA22.




La resonancia magnética constituye una alternativa a la TC en caso de contraindicaciones a ésta (insuficiencia renal, alergia a medio de contraste yodado). Sin embargo, su sensibilidad parece ser inferior a la TC (entre 63 y 86%; 75% para lesiones <2cm), aunque con cierta superioridad en la evaluación del uréter23,24. Por otro lado, debe considerarse que en pacientes con tasa de filtración glomerular <30 ml/min está igualmente contraindicada por eventual nefrotoxicidad, siendo de esta manera un recurso limitado.
La cistoscopía es componente mandatorio en todo estudio diagnóstico del CVUA en atención a la frecuente asociación con cáncer de vejiga. Con respecto a la citología urinaria, si bien no existe tanta evidencia como en vejiga y la precisión es inferior, con sensibilidades entre 43 y 78%, constituye igualmente una herramienta relevante, al tener una buena correlación con tumores de alto grado, en especial carcinoma in situ25. Es justamente en la detección de estos tumores donde las imágenes muestran mayores problemas. Para lograr esta buena correlación, debe ser obtenida de manera selectiva en la vía urinaria alta mediante cateterismo o bien durante una Ureterorrenoscopía sin manipulación previa, lo cual disminuye de manera significativa la tasa de falsos positivos26.
La utilización de hibridación con fluorescencia in situ (FISH) también ha sido planteada en el estudio del CVUA. Sin embargo, su pobre valor predictivo positivo (23%) desaconseja su uso a la espera de mayor evidencia27.
El diagnóstico endoscópico del CVUA mediante ureterorrenoscopía flexible (URS flex) incluye la visualización directa del tumor y la recolección de muestras para estudio citológico e histopatológico. Los ureteroscopios flexibles actuales permiten acceso primario e inspección de todo el tracto superior en hasta el 95% de los pacientes28. El diseño y calibre de la punta, el diámetro del cuerpo y la capacidad de deflexión de los instrumentos influyen en la probabilidad de un acceso exitoso. Los ureteroscopios flexibles de menor diámetro (cuerpo <8Fr) siguen siendo aquellos de fibra óptica. Los ureteroscopios flexibles digitales, tanto reutilizables como desechables, proporcionan una calidad óptica superior, pero a costa de una deflexión distal menos versátil y un calibre algo mayor (cuerpo 8,4 – 9,9Fr, dependiendo del fabricante/modelo)29,30.
La indicación de realizar una URS flex frente al diagnóstico clínico e imagenológico presuntivo de un CVUA es relativa. En las principales guías clínicas se recomienda su realización sólo si se espera que el resultado de la URS flex influya en el plan terapéutico. Por lo demás, las recomendaciones se basan reconocidamente en un bajo nivel de evidencia. No obstante, el diagnóstico de CVUA mediante URS flex es de especial utilidad cuando existe incertidumbre respecto al diagnóstico o cuando se requiere planificar un tratamiento conservador (función renal global disminuida, riñón único)31.
Dado que el estadio tumoral y el grado histológico son los principales factores pronósticos del CVUA, es de gran relevancia determinarlos en forma veraz. El rendimiento de la URS flex con biopsia y/o citología es bajo en cuanto a la etapificación local (T). En cambio, la determinación del grado histológico mediante biopsia ureteroscópica es bastante más precisa. De hecho, la comparación entre el resultado histopatológico de la ureteroscopía versus la nefroureterectomía radical (NUR) en distintos estudios muestra una correlación de sólo 43-60% para el estadio tumoral y de 87-93% para el grado histológico32,33. Sin embargo, los tumores de bajo grado en la biopsia ureteroscópica demostraron ser de alto grado en 44% y músculo invasores en 29% de las muestras de NUR en un estudio34.
La combinación de múltiples variables, como grado histológico y citología obtenidos por URS flex, localización y arquitectura tumoral y la presencia o ausencia de hidronefrosis en imágenes, ha demostrado tener un mayor valor predictivo en algunas publicaciones. Así, la suma de una biopsia endoscópica con CVUA de alto grado, citología positiva más hidronefrosis predice un tumor músculo invasor en 89% y no órgano confinado en 73%35,36.
La técnica de URS flex para el diagnóstico de CVUA merece algunas consideraciones especiales (ver video adjunto). Cada vez que sea posible debería intentarse una inspección inicial “sin tocar” el uréter previamente. Es decir, sin introducir una guía hasta la pelvis renal antes de iniciar la ureteroscopía. Esto permite visualizar lesiones a lo largo de todo el uréter y en el sistema colector intrarrenal sin el artefacto o hemorragia que potencialmente pudiera causar la manipulación previa (Figura 3). Para acceder al tracto superior generalmente es necesario, eso sí, al menos dilatar el orificio ureteral y el uréter distal con un ureteroscopio semirrígido o un dilatador (secuencial, coaxial o balón) sobre una guía apenas insinuada. No existe evidencia suficiente para recomendar el uso rutinario de vaina de acceso ureteral, aunque ésta puede facilitar la toma de múltiples muestras para biopsia37.
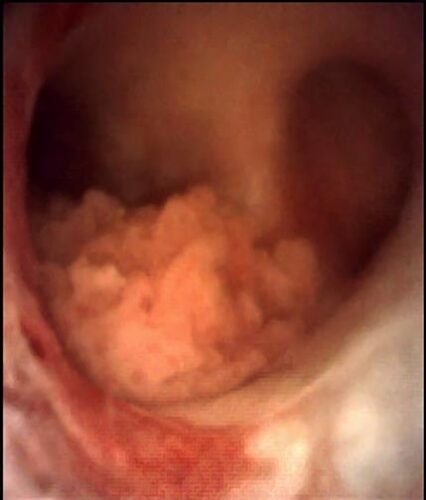

Durante la URS flex diagnóstica debería registrarse detalladamente el hallazgo de lesiones sospechosas, indicando localización, número y tamaño aproximado. Además es necesario describir su aspecto (plano, sésil, pediculado) y la impresión macroscópica de corresponder a una lesión de bajo o alto grado. Idealmente debe tomarse muestra para citología localizada, ya sea mediante lavado (con jeringa y solución salina) o cepillo para citología, cuya punta luego se corta y envía a análisis. Las lesiones sospechosas deberían ser biopsiadas con pinzas de biopsia endoscópicas o con un canastillo de nitinol de 4 hebras. Esto resulta relativamente sencillo con lesiones papilares y de mayor volumen, pero puede ser bastante dificultoso ante lesiones planas, muy pequeñas o en localizaciones que no permiten abordar la lesión de frente. De todos modos, el tamaño de las muestras obtenidas habitualmente es muy pequeño, por lo que es recomendable tomar más de una muestra. Existen diferentes pinzas de biopsia disponibles en el mercado, siendo posible la obtención de muestras de mayor tamaño con ciertas pinzas que requieren ser cargadas en forma retrógrada en el ureteroscopio38.
La aplicación de tecnologías avanzadas para una mejor visualización, como “narrow band imaging” (NBI), diagnóstico fotodinámico (PDD) o variaciones del espectro de la luz incorporadas en ciertos equipos, pueden aumentar el rendimiento diagnóstico30. La tomografía óptica coherente (OCT) y la endomicroscopía confocal mediante láser (CLE) han demostrado en forma preliminar proporcionar imágenes in vivo de la arquitectura y extensión tumoral con buena correlación con la histopatología final en cuanto a grado e incluso estadio tumoral39,40.
En suma, la URS flex diagnóstica para el CVUA es un procedimiento bien establecido, útil y seguro. Sin embargo, existe amplia evidencia de una mayor probabilidad de recurrencia intravesical tras su realización, entre ellas un reciente metanálisis de más de 3.500 pacientes41. De acuerdo a esto, es razonable la instilación intravesical de una dosis única de un agente quimioterapéutico en el postoperatorio inmediato, por ejemplo gemcitabina 2g (en 50ml de solución salina), para reducir este riesgo, si bien aún hacen falta estudios prospectivos que confirmen la necesidad de esta conducta.
Factores pronósticos preoperatorios
La determinación de pronóstico previo a la decisión terapéutica es crucial en el CVUA, tomando en consideración el agresivo carácter de la enfermedad. Para este efecto, distintos factores pronósticos preoperatorios, es decir previos al tratamiento quirúrgico definitivo (p.ej. NUR), permiten la estratificación de los pacientes en bajo y alto riesgo.
Características del paciente
La edad avanzada ha demostrado ser un significativo factor pronóstico negativo para sobrevida en numerosos estudios, con HR de hasta 2.5 para >80 años42. Sin embargo, la edad cronológica por sí sola nunca debiera imposibilitar un intento de tratamiento curativo. Por otro lado, sexo y raza han sido consistentemente descartados como factores pronósticos relevantes42.
El tabaquismo se asocia de manera significativa con recurrencia y mortalidad en el CVUA, como ha sido demostrado en un reciente metanálisis de 2.259 pacientes (HR 1.57 y 1.53 respectivamente)43. En otro estudio, se observó que la cesación del hábito iguala el riesgo mortalidad con no fumadores luego de aproximadamente 10 años44. De esta manera, el tabaquismo no solamente es el factor de riesgo más relevante para la ocurrencia de CVUA, si no que también constituye el factor pronóstico prevenible por excelencia. Esto reafirma la relevancia de la consejería de cesación en el manejo del cáncer. Es conocido que el diagnóstico es un momento que se presta para una conducta activa en ese sentido, haciendo necesario un rol más activo del urólogo en esta tarea.
Características del tumor
Dentro de las características del tumor, las más relevantes en el preoperatorio son son la presencia de alto grado tumoral en la biopsia por ureteroscopía y/o en la citología urinaria selectiva (ver sección de estudio diagnóstico endoscópico), la presencia de hidronefrosis45, multifocalidad46 y arquitectura sésil47. Todas ellas se asocian de manera significativa a desenlaces inferiores, ya sea enfermedad avanzada y/o menor sobrevida42.
Por otro lado, diversos estudios han mostrado asociación de tumores mayores a 3 ó 4 cms con un mal pronóstico. Sin embargo, este factor requiere mayor validación, ya que tumores Ta pueden en teoría alcanzar un gran tamaño con bajo riesgo de progresar a tumores invasores42. La localización (ureter vs. pelvis renal) ha sido materia de controversia al no existir resultados consistentes en las distintas series y actualmente no es considerado un factor relevante42. El estadío T, si bien se asocia significativamente con pronóstico, puede ser díficil de ser determinado en el preoperatorio debido a las limitaciones de los estudios de imágenes y de la biopsia endoscópica (ver estudio diagnóstico). Finalmente, y de manera más reciente, una revisión sistemática de más de 12.000 pacientes reveló una significativa asociación de la presencia de variantes histológicas, en especial la micropapilar y/o escamosa/glandular, con una menor sobrevida específica y global48.
De acuerdo a lo anterior, los pacientes son catalogados como de alto y bajo riesgo por las guías clínicas en la actualidad. Sin embargo, debe consideratse que todas las recomendaciones están basadas en datos retrospectivos con un bajo nivel de evidencia, dificultando de esta manera la toma de decisión. Existe una urgente necesidad de confirmación de estos datos con estudios prospectivos.
La enfermedad de bajo riesgo se define como un tumor único, unifocal, <2 cm, con citología y biopsia de bajo grado y sin aspecto invasor en TC, siendo necesario la presencia de todos ellos31. En estos casos se recomienda proceder con alguna modadlidad de tratamiento conservador (manejo endoscópico, percutáneo o cirugía segmentaria). Por otro lado, se considera de alto riesgo a un paciente con citología o biopsia con alto grado, tumor de >2cms, multifocal, con hidronefrosis o variante histológica. Existiendo solamente uno de estos factores se recomienda proceder con NUR31.
Tratamiento de enfermedad localizada
Tratamiento endoscópico y percutáneo
En tumores de bajo riesgo (véase pronóstico y estratificación de riesgo) las diferentes opciones de tratamiento con preservación de nefrones tienen globalmente resultados oncológicos equivalentes a la NUR, sin los riesgos particulares y la pérdida de función renal asociados a esta última49. Dentro de las modalidades conservadoras el tratamiento endoscópico, mediante abordaje retrógrado (URS flex) o anterógrado (percutáneo), pueden ser utilizados para tratar tumores del tracto superior. La URS flex tiene la ventaja de mantener un sistema cerrado con muy bajo riesgo de diseminación por fuera del sistema colector (salvo en casos de perforación). En cambio, se ha descrito siembra tumoral a nivel del tracto en casos tratados por vía percutánea, por lo cual existe actualmente una tendencia al abandono de esta práctica50.
La terapia endoscópica del CVUA mediante URS flex debe considerar los siguientes aspectos:
– Puede realizarse al mismo tiempo que la ureteroscopía diagnóstica, luego de completar los pasos descritos para ésta, siempre y cuando se trate de un tumor clínicamente catalogado como de bajo riesgo.
– Se requiere contar con experiencia en endourología y disponibilidad de instrumental adecuado, específicamente ureteroscopio flexible y un generador de láser.
– Debe evaluarse la factibilidad de tratar en forma completa el tumor objetivo, mediante resección y/o ablación, ya sea en uno o dos tiempos; además posteriormente se requiere de seguimiento endoscópico frecuente y estricto.
– El paciente debe estar debidamente informado, de acuerdo y en condiciones de adherir a lo anterior51.
En la actualidad el principal láser utilizado para esta terapia es el holmio, dada su efectividad y seguridad (profundidad de penetración = 0,5mm) (Figura 4). El láser de neodimio permite una buena coagulación, pero su penetración es de 5-6mm, por lo que el riesgo de daño parietal y estenosis (en lesiones ureterales) es mayor. Los parámetros habitualmente utilizados para la ablación mediante láser Ho:YAG son energía de 0,6-1J y frecuencia de 10Hz. Luego de la ablación rutinariamente se introduce un catéter doble jota, el cual se mantiene por al menos 1 semana38.


La instilación de BCG o agentes quimioterapéuticos en el tracto superior ha sido estudiada, sin embargo, no existe evidencia suficiente para su aplicación rutinaria52.
La sobrevida cáncer específica para pacientes con tumores de bajo riesgo tratados en forma endoscópica es equivalente a la de aquellos tratados mediante NUR. Sin embargo, aún para tumores de bajo grado, el riesgo de recurrencia intravesical aumenta por el hecho de realizar una URS flex, tal como fue explicado en la sección previa. Por otro lado, existe evidencia reciente que indica que la sobrevida global para pacientes con CVUA de bajo riesgo tratados con URS flex podría ser inferior que la obtenida con NUR en aquellos pacientes con tumores de más de 15mm53.
Cirugía segmentaria – Ureterectomía distal
En caso de que el tumor sea de uréter distal y de bajo riesgo, se puede realizar cirugía segmentaria con una ureterectomía distal con reimplante ureteral. Lo mismo es planteable en tumores de alto riesgo con necesidad de preservar riñón54. Al igual que la NUR, el abordaje laparoscópico está establecido y se acompaña con linfadenectomía si está indicada.
Nefroureterectomía radical
La NUR abierta con resección del cuff o manguito vesical es el tratamiento estándar para el CVUA de alto riesgo. Debe seguir los principios oncológicos quirúrgicos: prevenir siembra tumoral evitando la transgresión de la vía urinaria durante la cirugía55. Incluye la resección del uréter distal hasta el orificio ureteral, ya que en este punto existe un alto riesgo de recurrencia56. Diferentes técnicas se han desarrollado para la mencionada resección, incluyendo abordajes como el laparoscópico completo o técnicas endoscópicas tales como la técnica de destechamiento ureteral y o la técnica del “tirón” modificada. Todas ellas son comparables a la cirugía abierta con escisión del uréter distal y del manguito vesical. Sin embargo, las endoscópicas han sido paulatinamente abandonadas ante el riesgo de recidiva tumoral en el retroperitoneo57.
En un esfuerzo por reducir el carácter invasivo del procedimiento, la tecnología y las innovaciones de la nefrectomía laparoscópica se han aplicado a la nefroureterectomía laparoscópica, que se realizó por primera vez en 199158. Numerosos estudios retrospectivos han demostrado que este procedimiento tiene una menor morbilidad. Posteriormente, un estudio prospectivo randomizado confirmó que el abordaje laparoscópico ofrece un control oncológico equivalente a la cirugía abierta59,60. Más recientemente, el abordaje robótico ha mostrado resultados comparables a la cirugía laparoscópica61. Ha existido cierto debate sobre los diversos abordajes como el transperitoneal, retroperitoneal o con asistencia manual, sin embargo ninguno de ellos ha destacado de manera evidente sobre el otro, ofreciendo todos menor morbilidad en comparación con la alternativa abierta. De esta manera, el abordaje escogido depende en gran medida de factores del paciente y de la experiencia del cirujano.
La cirugía laparoscópica del CVUA exige ciertas medidas con el objetivo de evitar siembra tumoral en retroperitoneo y en las zonas de inserción de los trócares, y de esta manera mantener los principios oncológicos de la cirugía62. La más relevantes son evitar el ingreso a la vía urinaria, evitar el contacto directo de los instrumentos con el tumor, evitar morcelamiento de la pieza y extraer todo en bloc en una bolsa. Las guías europeas no recomiendan su uso en tumores avanzados y de gran volumen (T3/T4 y/o N+/M+) ante la dificultad de cumplir con lo anteriormente mencionado63
Linfadenectomía
Los templados de disección de la Linfadenectomía para el CVUA no están claramente definidos. El rendimiento es mayor en tumores pT2-T4 con cerca del 16% de pN+, confirmándose de esta manera que esta probabilidad aumenta con mayor estadío pT. Los templados descritos por Kondo de acuerdo a la localización del tumor son uno de los modelos más considerados por la comunidad urológica (Figura 5)64.


Técnica de la NUR laparoscópica
Se posiciona al paciente decúbito lateral de acuerdo con el lado del tumor, con un leve quiebre de la mesa por sobre la cadera, teniendo dentro de nuestro campo estéril acceso a la uretra. Se instala así una sonda uretrovesical, la cual permite drenaje vesical y hacer pruebas para verificar que el cierre de la vejiga sea hermético.
Debe elevarse la cadera, flanco y hombro ipsilaterales y llevar el brazo ipsilateral por encima de la mesa, depositándolo en una piernera, protegido con una almohadilla, o bien dejarlo flexionado frente a la cara del paciente sobre una almohada. Recomendamos uso de un rollito axilar. El paciente debe fijarse con cuidado a la mesa mediante cinta adhesiva de tela, que se dispone en el tórax y otra en la cadera (dejando espacio al acceso uretral)
Como nuestro abordaje es preferentemente por vía abdominal, el cirujano y el ayudante se sitúan por el lado abdominal del paciente y los equipos (torre laparoscópica, electrobisturí eléctrico para energía monopolar y bipolar y/u otra consola con energía, aspiración/irrigación) por el dorso del paciente.
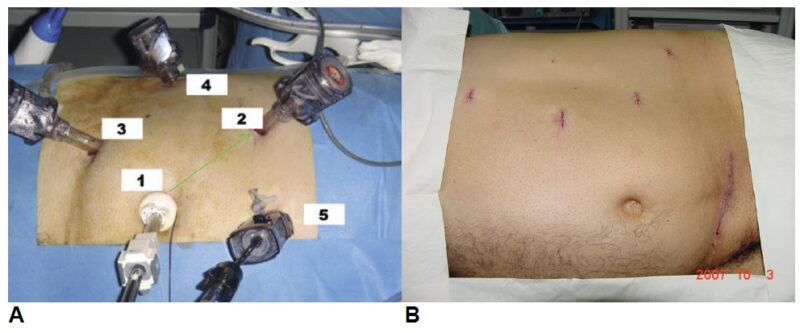
Se instalan 5 trócares a derecha (el suplementario es para elevar y suspender el hígado) y a izquierda 4 trócares (Figura 6 A y B). El abdomen se insufla con una aguja de Veress en el flanco a operar a una presión intraabdominal entre 12 y 15 mm de Hg. El primer trócar de 12 mm se introduce a nivel paraumbilical un poco por sobre el ombligo, de preferencia con trocares con visión y óptica de 0º. Luego, bajo visión peritoneal se instalan en triangulación un trócar en hipocondrio y otro en flanco para ser usados por el cirujano además de otro trócar en la fosa ilíaca respectiva para ser usado por el ayudante, quien tendrá la cámara y este acceso para favorecer la exposición del cirujano. A derecha colocamos un trocar a nivel de la apófisis xifoides. El higado se eleva con una pinza con fijación.

Tras la instalación de los trócares, la mesa se inclina para colocar al paciente en una posición de flanco. El peritoneo posterior se incide en la línea de Toldt, lo que permite movilizar y desplazar el mesenterio del colon en sentido medial a la aorta en el lado izquierdo y a la vena cava en el derecho. En la disección del lado derecho, la incisión se prolonga desde los vasos ilíacos hasta la reflexión hepática, realizando la maniobra de Kocher, exponiendo el duodeno, se desciende hacia medial y se ubica la vena cava. En el lado izquierdo, la incisión se extiende en sentido cefálico hasta la reflexión esplénica Los ligamentos colorrenales se seccionan para permitir mayor movilización del colon, separándolo del polo inferior del riñón. Las inserciones laterales de la fascia de Gerota deben dejarse para que el riñón no caiga en sentido medial durante la disección del hilio renal.
Luego en ambos lados ubicamos el uréter a nivel del polo inferior del riñón y ascendemos nuestra disección hacia el hilio renal, manteniendo un margen amplio de tejido si se conoce o se sospecha la existencia de un tumor ureteral invasivo. Al lado izquierdo junto con la identificación del uréter, ubicamos la vena gonadal, y ambos elementos se elevan con una pinza por el ayudante y al seguir la vena gonadal hacia cefálico ubicamos la vena renal izquierda. A derecha esta maniobra no es posible y hacemos nuestra disección por la cara externa de la vena gonadal, llegamos a la vena cava y de ahí ubicamos la vena renal derecha. En ambos lados disecamos la arteria renal que esta por detrás y un poco arriba de la vena. La arteria renal es clipeada y seccionada. La vena renal de preferencia es doblemente clipeada y en aquellos casos con una vena muy ancha usamos sutura mecánica tipo vascular. En el lado izquierdo clipeamos y cortamos la vena suprarrenal y gonadal y si es necesario debemos seccionar venas lumbares para así tener un mejor acceso al control de la arteria renal izquierda.
Se libera el polo superior del riñón, en ambos lados se preserva la glándula suprarrenal, luego liberamos la porción lateral del riñón y el polo inferior para completar la nefrectomía. Previo a liberar el uréter hasta la vejiga realizamos la linfadenectomía de acuerdo con los templados descritos. Se prosigue con la disección del uréter hacia distal. Se accede a espacio prevesical, se secciona el conducto deferente en el varón o el ligamento redondo en la mujer para permitir una disección posterior más sencilla. Se libera el uréter hasta su inserción vesical realizando un manguito de vejiga que incluye el orificio ureteral. Previo a abrir la vejiga es conveniente clipear el uréter para evitar extravasación de orina.
En el trayecto pélvico del uréter debe ponerse atención en controlar vasos ureterales que nacen de los vasos ilíacos comunes, en especial de la porción inferior de la arteria vesical inferior y ramas de la uterina. Antes de acceder a la vejiga existen dos métodos para el manguito vesical. Una es la disección completa por vía laparoscópica. Luego se sutura vejiga, teniendo mucho cuidado de no dañar el orificio ureteral contralateral, siendo eventualmente necesaria la realización de una cistoscopia flexible. Se extrae toda la pieza en bloc en una bolsa a través de una incisión de Pfannestiel y se verifica una correcta cistorrafia instilando suero fisiológico por la sonda uretrovesical. Se retiran los trócares bajo visión directa, siendo conveniente cerrar la aponeurosis de los trócares de 12 mm, para evitar hernias. Si no se está familiarizado con sutura intracorpórea, se puede proceder con una incisión de Gibson. Se diseca en forma abierta el uréter hasta la vejiga con todo su trayecto intramural. Al traccionarlo se forma un triángulo donde se pone un ángulo curvo, cortando con tijera el manguito vesical y suturando por debajo del ángulo. De esta manera no se abre la vejiga y no hay extravasación de orina. Se extrae toda la pieza en bloc.
Las posibles complicaciones relacionadas con la NUR son similares a las de otros procedimientos laparoscópicos abdominales. Entre las complicaciones intraoperatorias pueden citarse la hemorragia con necesidad de transfusión y la lesión de hígado, bazo, páncreas, intestino o estructuras vasculares. Todo el personal quirúrgico debe estar preparado para una conversión inmediata a un procedimiento abierto. Hay que prestar atención cuidadosa al orificio ureteral contralateral durante la disección para evitar su lesión inadvertida. Entre las complicaciones postoperatorias se encuentra el dolor neuromuscular secundario al posicionamiento del paciente, la formación de hematomas, la infección de la herida, un íleo prolongado o una obstrucción del intestino delgado, la formación de adherencias y la fístula urinaria prolongada.
Quimioterapia intravesical adyuvante
Con motivo de la elevada frecuencia de recidiva intravesical luego de NUR (hasta 50%), diversos estudios han explorado la utilidad de una dosis de quimioterapia intravesical (ej. Mitomicina) en el postoperatorio inmediato65,66. Existen en la actualidad numerosos estudios mostrando un beneficio de alrededor de un 40% en términos de reducción de recidiva intravesical, lo cual ha llevado a recomendar esta práctica de manera rutinaria en las guías clínicas.
Quimoterapia sistémica perioperatoria
Al igual que en el cáncer de vejiga, el esquema de elección es basado en Cisplatino. De acuerdo a esto, la función renal juega un rol crítico en la elegibilidad, considerando que la NUR tiene un impacto en ésta. La quimioterapia neoadyuvante presenta la ventaja que evita este problema, al ser realizada previo a la cirugía. Sin embargo existe escasa evidencia para CVUA, con algunos estudios retrospectivos mostrando un beneficio en términos de sobrevida, especialmente en tumores localmente avanzados67,68.
Por otro lado, la quimioterapia adyuvante presenta la ventaja que permite seleccionar al paciente de acuerdo a factores de riesgo postoperatorios. Sin embargo, una significativa proporción resulta no ser elegible debido a la presencia de una función renal disminuida. Similar a la terapia neoadyuvante, la evidencia es limitada y con resultados contradictorios69, pero cabe mencionar que ya existen resultados del primer ensayo controlado (POUT) que reveló un beneficio significativo de quimioterapia adyuvante en CVUA en términos de sobrevida libre de enfermedad (70 vs. 50%; HR=0,47; IC95%: 0,29-0,74; p=0,0009) y libre de progresión (HR = 0,49; IC95%: 0,30-0,79; p=0,003) a los 2 años de seguimiento70.
Tratamiento de enfermedad metastásica
El CVUA metastásico es raramente curable y es de esta manera un gran desafío para el desarrollo de nuevas terapias.
Nefroureterectomía radical y Metastasectomía
Recientes estudios con bases de datos poblacionales de EEUU han sugerido un impacto positivo de la NUR así como de la resección de metástasis en la sobrevida de un seleccionado grupo de pacientes con enfermedad metastásica tratados con quimioterapia71-73. Sin embargo, considerando la altísima probabilidad de sesgo en este tipo de estudios, no es posible generar una recomendación al respecto.
Terapia sistémica
La evidencia en terapia sistémica del CVUA es escasa al estar compuesta de estudios con un limitado número de pacientes. De esta manera, el manejo ha sido esencialmente extrapolado de las recomendaciones para el manejo del cáncer de vejiga metastásico en cuanto a quimioterapia basada en Cisplatino74. Sin embargo, debe considerarse que los grandes estudios han de hecho incluido una proporción de pacientes con CVUA y un reciente estudio analizando esto en 3 ensayos clínicos europeos con 1.061 pacientes (161 pacientes con CVUA) determinó que la localización del tumor primario no tiene impacto en la sobrevida global, siendo de 17% a 3 años75. Como alternativa, en especial en pacientes no elegibles para terapia basada en cisplatino (función renal disminuida), recientes estudios incluyendo pacientes con CVUA han mostrado una respuesta equivalente con el uso de inmunoterapia (inhibidores de checkpoints)76. La misma estrategia está en intensa evaluación en caso de progresión ante la pobre respuesta a esquemas de quimioterapia de segunda línea77.
Seguimiento
El CVUA, al igual que el cáncer de vejiga, requiere de un seguimiento estricto de por vida luego de cualquier tratamiento, al existir un riesgo significativo de recurrencia intravesical (entre 20 y 50%), local y sistémica, y en el caso de manejo conservador de recurrencia en el tracto urinario alto ipsilateral. Los esquemas de seguimiento se basan en bajos niveles de evidencia, al no existir estudios prospectivos31.
En los pacientes tratados con NUR se recomienda un seguimiento periódico con Cistoscopía con una periodicidad dependiente del riesgo, siendo la primera siempre necesaria a los 3 meses. En pacientes de alto riesgo debe agregarse además citología urinaria en cada cistoscopía. Para la exploración de recurrencia sistémica, se recomienda la realización de una imagen axial de tórax, abdomen y pelvis cada 6 meses los 2 primeros años y luego en forma anual.
En el caso de manejo conservador (endoscópico, percutáneo o cirugía segmentaria) se recomienda la realización de una cistoscopía y una Uro TAC a los 3 y 6 meses y luego en forma anual. En los tumores de alto riesgo debe agregarse citología urinaria y una TC de Tórax. La ureteroscopía por su parte, está recomendada a los 3 y 6 meses, con citología selectiva en el caso de tumores de alto grado.
Bibliografía
1. Soria F, Shariat SF, Lerner SP, et al. Epidemiology, diagnosis, preoperative evaluation and prognostic assessment of upper-tract urothelial carcinoma (UTUC). World J Urol. 2017;35(3):379-387.
2. Espinoza C, Umaña M, Sanhueza J, Sandoval M. Registro Poblacional de Cáncer Provincia de Concepción 2006-2010. In: Secretaría Regional Ministerial de Salud Región del Biobío; 2017:88-89.
3. Galaz J, Moya J, Vallebuona C, Soto F. Registro Poblacional de Cáncer Antofagasta. In. Vol 1: Secretaría Regional Ministerial de Salud Antofagasta; 2016:28-29.
4. Picozzi S, Ricci C, Gaeta M, et al. Upper urinary tract recurrence following radical cystectomy for bladder cancer: a meta-analysis on 13,185 patients. J Urol. 2012;188(6):2046-2054.
5. Wright JL, Hotaling J, Porter MP. Predictors of upper tract urothelial cell carcinoma after primary bladder cancer: a population based analysis. J Urol. 2009;181(3):1035-1039; discussion 1039.
6. Wang YH, Yeh SD, Wu MM, et al. Comparing the joint effect of arsenic exposure, cigarette smoking and risk genotypes of vascular endothelial growth factor on upper urinary tract urothelial carcinoma and bladder cancer. J Hazard Mater. 2013;262:1139-1146.
7. Crivelli JJ, Xylinas E, Kluth LA, Rieken M, Rink M, Shariat SF. Effect of smoking on outcomes of urothelial carcinoma: a systematic review of the literature. Eur Urol. 2014;65(4):742-754.
8. Grollman AP. Aristolochic acid nephropathy: Harbinger of a global iatrogenic disease. Environ Mol Mutagen. 2013;54(1):1-7.
9. Colin P, Koenig P, Ouzzane A, et al. Environmental factors involved in carcinogenesis of urothelial cell carcinomas of the upper urinary tract. BJU Int. 2009;104(10):1436-1440.
10. Roupret M, Drouin SJ, Cancel-Tassin G, Comperat E, Larre S, Cussenot O. Genetic variability in 8q24 confers susceptibility to urothelial carcinoma of the upper urinary tract and is linked with patterns of disease aggressiveness at diagnosis. J Urol. 2012;187(2):424-428.
11. Audenet F, Colin P, Yates DR, et al. A proportion of hereditary upper urinary tract urothelial carcinomas are misclassified as sporadic according to a multi-institutional database analysis: proposal of patient-specific risk identification tool. BJU Int. 2012;110(11 Pt B):E583-589.
12. Lamm SH, Engel A, Penn CA, Chen R, Feinleib M. Arsenic cancer risk confounder in southwest Taiwan data set. Environ Health Perspect. 2006;114(7):1077-1082.
13. Lopez JF, Fernandez MI, Coz LF. Arsenic exposure is associated with significant upper tract urothelial carcinoma health care needs and elevated mortality rates. Urol Oncol. 2020; doi.org/10.1016/j.urolonc.2020.01.014.
14. Moch H, Humphrey PA, Ulbright TM, Reuter V. WHO classification of classification of tumours of the urinary system and male genital organs. Lyon2016.
15. Humphrey PA, Moch H, Cubilla AL, Ulbright TM, Reuter VE. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours. Eur Urol. 2016;70(1):106-119.
16. Amin MH, Edge SB, Greene FL. AJCC Cancer Staging Manual. 8th ed. Cham, Switzerland: Springer; 2017.
17. Cowan NC. CT urography for hematuria. Nat Rev Urol. 2012;9(4):218-226.
18. Raman JD, Shariat SF, Karakiewicz PI, et al. Does preoperative symptom classification impact prognosis in patients with clinically localized upper-tract urothelial carcinoma managed by radical nephroureterectomy? Urol Oncol. 2011;29(6):716-723.
19. Jinzaki M, Matsumoto K, Kikuchi E, et al. Comparison of CT urography and excretory urography in the detection and localization of urothelial carcinoma of the upper urinary tract. AJR Am J Roentgenol. 2011;196(5):1102-1109.
20. Fritz GA, Schoellnast H, Deutschmann HA, Quehenberger F, Tillich M. Multiphasic multidetector-row CT (MDCT) in detection and staging of transitional cell carcinomas of the upper urinary tract. Eur Radiol. 2006;16(6):1244-1252.
21. Sadow CA, Wheeler SC, Kim J, Ohno-Machado L, Silverman SG. Positive predictive value of CT urography in the evaluation of upper tract urothelial cancer. AJR Am J Roentgenol. 2010;195(5):W337-343.
22. Tanaka H, Yoshida S, Komai Y, et al. Clinical Value of 18F-Fluorodeoxyglucose Positron Emission Tomography/Computed Tomography in Upper Tract Urothelial Carcinoma: Impact on Detection of Metastases and Patient Management. Urol Int. 2016;96(1):65-72.
23. Takahashi N, Glockner JF, Hartman RP, et al. Gadolinium enhanced magnetic resonance urography for upper urinary tract malignancy. J Urol. 2010;183(4):1330-1365.
24. Sudah M, Masarwah A, Kainulainen S, et al. Comprehensive MR Urography Protocol: Equally Good Diagnostic Performance and Enhanced Visibility of the Upper Urinary Tract Compared to Triple-Phase CT Urography. PLoS One. 2016;11(7):e0158673.
25. Messer J, Shariat SF, Brien JC, et al. Urinary cytology has a poor performance for predicting invasive or high-grade upper-tract urothelial carcinoma. BJU Int. 2011;108(5):701-705.
26. Malm C, Grahn A, Jaremko G, Tribukait B, Brehmer M. Diagnostic accuracy of upper tract urothelial carcinoma: how samples are collected matters. Scand J Urol. 2017;51(2):137-145.
27. Fernandez MI, Parikh S, Grossman HB, et al. The role of FISH and cytology in upper urinary tract surveillance after radical cystectomy for bladder cancer. Urol Oncol. 2012;30(6):821-824.
28. Traxer O, Geavlete B, de Medina SG, Sibony M, Al-Qahtani SM. Narrow-band imaging digital flexible ureteroscopy in detection of upper urinary tract transitional-cell carcinoma: initial experience. J Endourol. 2011;25(1):19-23.
29. Gridley CM, Knudsen BE. Digital ureteroscopes: technology update. Res Rep Urol. 2017;9:19-25.
30. Keller EX, Doizi S, Villa L, Traxer O. Which flexible ureteroscope is the best for upper tract urothelial carcinoma treatment? World J Urol. 2019;37(11):2325-2333.
31. Rouprêt M, Babjuk M, Burger M, Compérat E. EAU Guidelines on Upper Urinary Tract Urothelial Carcinoma. EAU Guidelines Office. https://uroweb.org/guideline/upper-urinary-tract-urothelial-cell-carcinoma/. Published 2019. Accessed 31/12/2019, 2019.
32. Vashistha V, Shabsigh A, Zynger DL. Utility and diagnostic accuracy of ureteroscopic biopsy in upper tract urothelial carcinoma. Arch Pathol Lab Med. 2013;137(3):400-407.
33. Rojas CP, Castle SM, Llanos CA, et al. Low biopsy volume in ureteroscopy does not affect tumor biopsy grading in upper tract urothelial carcinoma. Urol Oncol. 2013;31(8):1696-1700.
34. Clements T, Messer JC, Terrell JD, et al. High-grade ureteroscopic biopsy is associated with advanced pathology of upper-tract urothelial carcinoma tumors at definitive surgical resection. J Endourol. 2012;26(4):398-402.
35. Brien JC, Shariat SF, Herman MP, et al. Preoperative hydronephrosis, ureteroscopic biopsy grade and urinary cytology can improve prediction of advanced upper tract urothelial carcinoma. J Urol. 2010;184(1):69-73.
36. Margulis V, Youssef RF, Karakiewicz PI, et al. Preoperative multivariable prognostic model for prediction of nonorgan confined urothelial carcinoma of the upper urinary tract. J Urol. 2010;184(2):453-458.
37. Gorin MA, Santos Cortes JA, Kyle CC, Carey RI, Bird VG. Initial clinical experience with use of ureteral access sheaths in the diagnosis and treatment of upper tract urothelial carcinoma. Urology. 2011;78(3):523-527.
38. Samson P, Smith AD, Hoenig D, Okeke Z. Endoscopic Management of Upper Urinary Tract Urothelial Carcinoma. J Endourol. 2018;32(S1):S10-s16.
39. Bus MT, de Bruin DM, Faber DJ, et al. Optical Coherence Tomography as a Tool for In Vivo Staging and Grading of Upper Urinary Tract Urothelial Carcinoma: A Study of Diagnostic Accuracy. J Urol. 2016;196(6):1749-1755.
40. Fojecki G, Magnusson A, Traxer O, et al. Consultation on UTUC, Stockholm 2018 aspects of diagnosis of upper tract urothelial carcinoma. World J Urol. 2019;37(11):2271-2278.
41. Guo RQ, Hong P, Xiong GY, et al. Impact of ureteroscopy before radical nephroureterectomy for upper tract urothelial carcinomas on oncological outcomes: a meta-analysis. BJU Int. 2018;121(2):184-193.
42. Kardoust Parizi M, Glybochko PV, Enikeev D, et al. Risk stratification of upper tract urothelial carcinoma: A Review of the Current Literature. Expert Rev Anticancer Ther. 2019;19(6):503-513.
43. van Osch FH, Jochems SH, van Schooten FJ, Bryan RT, Zeegers MP. Significant Role of Lifetime Cigarette Smoking in Worsening Bladder Cancer and Upper Tract Urothelial Carcinoma Prognosis: A Meta-Analysis. J Urol. 2016;195(4 Pt 1):872-879.
44. Rink M, Xylinas E, Margulis V, et al. Impact of smoking on oncologic outcomes of upper tract urothelial carcinoma after radical nephroureterectomy. Eur Urol. 2013;63(6):1082-1090.
45. Messer JC, Terrell JD, Herman MP, et al. Multi-institutional validation of the ability of preoperative hydronephrosis to predict advanced pathologic tumor stage in upper-tract urothelial carcinoma. Urol Oncol. 2013;31(6):904-908.
46. Chromecki TF, Cha EK, Fajkovic H, et al. The impact of tumor multifocality on outcomes in patients treated with radical nephroureterectomy. Eur Urol. 2012;61(2):245-253.
47. Cha EK, Shariat SF, Kormaksson M, et al. Predicting clinical outcomes after radical nephroureterectomy for upper tract urothelial carcinoma. Eur Urol. 2012;61(4):818-825.
48. Mori K, Janisch F, Parizi MK, et al. Prognostic Value of Variant Histology in Upper Tract Urothelial Carcinoma Treated with Nephroureterectomy: A Systematic Review and Meta-Analysis. J Urol. 2019:101097ju0000000000000523.
49. Seisen T, Peyronnet B, Dominguez-Escrig JL, et al. Oncologic Outcomes of Kidney-sparing Surgery Versus Radical Nephroureterectomy for Upper Tract Urothelial Carcinoma: A Systematic Review by the EAU Non-muscle Invasive Bladder Cancer Guidelines Panel. Eur Urol. 2016;70(6):1052-1068.
50. Schwartzmann I, Pastore AL, Sacca A, et al. Upper Urinary Tract Urothelial Carcinoma Tumor Seeding along Percutaneous Nephrostomy Track: Case Report and Review of the Literature. Urol Int. 2017;98(1):115-119.
51. Roupret M, Babjuk M, Comperat E, et al. European Association of Urology Guidelines on Upper Urinary Tract Urothelial Carcinoma: 2017 Update. Eur Urol. 2018;73(1):111-122.
52. Jung H, Giusti G, Fajkovic H, et al. Consultation on UTUC, Stockholm 2018: aspects of treatment. World J Urol. 2019;37(11):2279-2287.
53. Upfill-Brown A, Lenis AT, Faiena I, et al. Treatment utilization and overall survival in patients receiving radical nephroureterectomy versus endoscopic management for upper tract urothelial carcinoma: evaluation of updated treatment guidelines. World J Urol. 2019;37(6):1157-1164.
54. Colin P, Ouzzane A, Pignot G, et al. Comparison of oncological outcomes after segmental ureterectomy or radical nephroureterectomy in urothelial carcinomas of the upper urinary tract: results from a large French multicentre study. BJU Int. 2012;110(8):1134-1141.
55. Margulis V, Shariat SF, Matin SF, et al. Outcomes of radical nephroureterectomy: a series from the Upper Tract Urothelial Carcinoma Collaboration. Cancer. 2009;115(6):1224-1233.
56. Seisen T, Granger B, Colin P, et al. A Systematic Review and Meta-analysis of Clinicopathologic Factors Linked to Intravesical Recurrence After Radical Nephroureterectomy to Treat Upper Tract Urothelial Carcinoma. Eur Urol. 2015;67(6):1122-1133.
57. Xylinas E, Rink M, Cha EK, et al. Impact of distal ureter management on oncologic outcomes following radical nephroureterectomy for upper tract urothelial carcinoma. Eur Urol. 2014;65(1):210-217.
58. Clayman RV, Kavoussi LR, Figenshau RS, Chandhoke PS, Albala DM. Laparoscopic nephroureterectomy: initial clinical case report. J Laparoendosc Surg. 1991;1(6):343-349.
59. Jarrett TW, Chan DY, Cadeddu JA, Kavoussi LR. Laparoscopic nephroureterectomy for the treatment of transitional cell carcinoma of the upper urinary tract. Urology. 2001;57(3):448-453.
60. Simone G, Papalia R, Guaglianone S, et al. Laparoscopic versus open nephroureterectomy: perioperative and oncologic outcomes from a randomised prospective study. Eur Urol. 2009;56(3):520-526.
61. Clements MB, Krupski TL, Culp SH. Robotic-Assisted Surgery for Upper Tract Urothelial Carcinoma: A Comparative Survival Analysis. Ann Surg Oncol. 2018;25(9):2550-2562.
62. Ong AM, Bhayani SB, Pavlovich CP. Trocar site recurrence after laparoscopic nephroureterectomy. J Urol. 2003;170(4 Pt 1):1301.
63. Peyronnet B, Seisen T, Dominguez-Escrig JL, et al. Oncological Outcomes of Laparoscopic Nephroureterectomy Versus Open Radical Nephroureterectomy for Upper Tract Urothelial Carcinoma: An European Association of Urology Guidelines Systematic Review. Eur Urol Focus. 2019;5(2):205-223.
64. Kondo T, Hashimoto Y, Kobayashi H, et al. Template-based lymphadenectomy in urothelial carcinoma of the upper urinary tract: impact on patient survival. Int J Urol. 2010;17(10):848-854.
65. O’Brien T, Ray E, Singh R, Coker B, Beard R. Prevention of bladder tumours after nephroureterectomy for primary upper urinary tract urothelial carcinoma: a prospective, multicentre, randomised clinical trial of a single postoperative intravesical dose of mitomycin C (the ODMIT-C Trial). Eur Urol. 2011;60(4):703-710.
66. Fang D, Li XS, Xiong GY, Yao L, He ZS, Zhou LQ. Prophylactic intravesical chemotherapy to prevent bladder tumors after nephroureterectomy for primary upper urinary tract urothelial carcinomas: a systematic review and meta-analysis. Urol Int. 2013;91(3):291-296.
67. Porten S, Siefker-Radtke AO, Xiao L, et al. Neoadjuvant chemotherapy improves survival of patients with upper tract urothelial carcinoma. Cancer. 2014;120(12):1794-1799.
68. Kubota Y, Hatakeyama S, Tanaka T, et al. Oncological outcomes of neoadjuvant chemotherapy in patients with locally advanced upper tract urothelial carcinoma: a multicenter study. Oncotarget. 2017;8(60):101500-101508.
69. Necchi A, Lo Vullo S, Mariani L, et al. Adjuvant chemotherapy after radical nephroureterectomy does not improve survival in patients with upper tract urothelial carcinoma: a joint study by the European Association of Urology-Young Academic Urologists and the Upper Tract Urothelial Carcinoma Collaboration. BJU Int. 2018;121(2):252-259.
70. Birtle AJ, Chester JD, Jones RJ, et al. Results of POUT: A phase III randomised trial of perioperative chemotherapy versus surveillance in upper tract urothelial cancer (UTUC). Journal of Clinical Oncology. 2018;36(6_suppl):407-407.
71. Dong F, Fu H, Shi X, et al. How do organ-specific metastases affect prognosis and surgical treatment for patients with metastatic upper tract urothelial carcinoma: first evidence from population based data. Clin Exp Metastasis. 2017;34(8):467-477.
72. Seisen T, Jindal T, Karabon P, et al. Efficacy of Systemic Chemotherapy Plus Radical Nephroureterectomy for Metastatic Upper Tract Urothelial Carcinoma. Eur Urol. 2017;71(5):714-718.
73. Faltas BM, Gennarelli RL, Elkin E, Nguyen DP, Hu J, Tagawa ST. Metastasectomy in older adults with urothelial carcinoma: Population-based analysis of use and outcomes. Urol Oncol. 2018;36(1):9.e11-19.e17.
74. Audenet F, Yates DR, Cussenot O, Roupret M. The role of chemotherapy in the treatment of urothelial cell carcinoma of the upper urinary tract (UUT-UCC). Urol Oncol. 2013;31(4):407-413.
75. Moschini M, Shariat SF, Roupret M, et al. Impact of Primary Tumor Location on Survival from the European Organization for the Research and Treatment of Cancer Advanced Urothelial Cancer Studies. J Urol. 2018;199(5):1149-1157.
76. Balar AV, Galsky MD, Rosenberg JE, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet. 2017;389(10064):67-76.
77. Rosenberg JE, Hoffman-Censits J, Powles T, et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet. 2016;387(10031):1909-1920.
