Capítulo 11
Incontinencia urinaria en la mujer
- Dra. Melissa Cifuentes A. (1- 2), Dra. Carolina Opazo T. (1), 1 Dr. Benjamín Brucker (2)
- (1) Hospital Carlos van Buren – Universidad de Valparaíso – (2) New York University (NYU)
Introducción
Incontinencia urinaria es el escape involuntario de orina. Según la Sociedad Internacional para la Continencia ICS, corresponde a un síntoma y a un signo. El síntoma es el relato de la paciente de cualquier escape involuntario de orina. El signo corresponde a la constatación de dicho escape (1).
Se trata de una condición muy frecuente en la población femenina, que altera diferentes esferas de la vida e impacta negativamente en la calidad de vida (2). Esta condición supone un problema social e higiénico que afecta la percepción general de la salud y el bienestar psicológico de las personas que la padecen, así como su capacidad de relacionarse con el entorno. Además, produce un impacto económico y laboral que conlleva una disminución de la productividad, ausentismo por enfermedad, movilidad laboral y aumento del gasto económico personal (3).
La prevalencia de la incontinencia de orina varía según su definición, severidad y población estudiada. La incidencia anual se describe entre un 2 y 11% de nuevos casos por año y su prevalencia oscila entre 10% y 40% de la población femenina (4). De forma global, se considera que las mujeres tienen una prevalencia de IU cercana al 30% (5). Si evaluamos la incontinencia moderada a severa, definida como escape de orina al menos una vez por semana, la prevalencia oscila entre el 13 y el 17% de la población femenina. El envejecimiento progresivo de la población, sumado a las comorbilidades como tabaquismo y obesidad, hacen que esta condición esté en aumento.
Los tres tipos clínicos de incontinencia corresponden a: Incontinencia Urinaria de Urgencia (IUU) como parte del Síndrome de Vejiga Hiperactiva, Incontinencia Urinaria de Esfuerzos (IUE), e Incontinencia Urinaria Mixta (IUM) donde existen manifestaciones de los dos primeros síndromes (1). Existe también un grupo de pacientes que presentan incontinencia de orina que no se logra caracterizar con los métodos disponibles por el médico tratante. Estas pacientes se pueden catalogar en el diagnostico operacional de Incontinencia Urinaria Atípica (IUA) y requieren mayor estudio para aclarar su diagnóstico etiológico. La tabla 1 enumera algunos tipos de incontinencia enumerados por la International Continence Society (ICS).
Síndrome de vejiga hiperactiva
El síndrome de vejiga hiperactiva (SVH) corresponde a un conjunto de signos y síntomas cuyo elemento eje es la urgencia miccional. Esta se define como deseo miccional súbito, intenso y difícil de diferir y se puede presentar con incontinencia urinaria (SVH húmeda) o sin incontinencia (SVH seca). Otros elementos que pueden estar presentes son el aumento de la frecuencia miccional diurna y la nocturia (1,6).
Si bien la literatura propone que la prevalencia del SVH estaría en aumento en relación al envejecimiento de la población, la real prevalencia de esta patología no se puede establecer con claridad. Lo anterior debido a las diferentes terminologías utilizadas y a que la mayoría de los estudios han sido realizados para evaluar la presencia de incontinencia por urgencia o urge incontinencia. Estudios basados en grandes grupos poblacionales indican que estaría presente entre el 9 y el 43% de la población femenina. Algunos estudios reportan una mayor prevalencia en mujeres que en hombres mientras que otros revelan prevalencias similares. Sin embargo, si analizamos la prevalencia de la incontinencia por urgencia, esta es marcadamente mayor en la población femenina. La prevalencia de los síntomas de SVH y su severidad tienden a incrementarse con la edad (7).
Las pacientes que padecen SVH tienden a restringir sus actividades cotidianas, experimentan alteraciones del sueño, depresión y marcado deterioro de la calidad de vida. Esto además del aumento del riesgo de caída y fracturas (8). El deterioro de la autoestima, la vergüenza y la necesidad de conocer la ubicación de todos los baños a su alrededor, son fenómenos que se repiten entre las mujeres con SVH.
Fisiopatología
Si bien no se ha definido claramente la causa de esta entidad patológica, existen importantes aportes a la comprensión de su fisiopatología que se enumeran a continuación:
Alison Brading el año 1997 sugiere que debe existir una alteración de los miocitos del detrusor como requisito necesario para que una contracción involuntaria pueda propagarse y producir un aumento de la presión intravesical. Posteriormente se ha demostrado que la micción con presiones elevadas lleva a períodos de isquemia en el detrusor, lo que a largo plazo dañaría las neuronas intramurales y el músculo liso vesical. Estos cambios podrían incrementar la excitabilidad y acoplamiento eléctrico entre los miocitos, resultando en que una contracción aislada en cualquier parte del detrusor pueda propagarse y ocasionar una contracción de toda la vejiga. Por último, la denervación parcial del detrusor causaría una hipersensibilidad de este a los neurotransmisores, con el consiguiente aumento de la respuesta al estímulo (9).
Múltiples autores destacan la importancia de la disfunción neurológica como etiología de la Vejiga Hiperactiva. El daño de los centros inhibitorios centrales y espinales o la sensibilización de los aferentes nerviosos vesicales podrían desinhibir los reflejos miccionales primitivos, que serían los encargados de desencadenar la hiperactividad vesical. Esto puede ocurrir por lesiones cerebrales (que inducirían una hiperactividad vesical por pérdida del control inhibitorio suprapontino) o por daño de las vías axonales espinales (que determinaría hiperactividad por activación de reflejos primitivos medulares gatillados por las aferencias vesicales).
El rol del urotelio, tanto referente a su permeabilidad como a su rol secretor de neurotransmisores (acetilcolina, ATP y óxido nítrico entre otros) está siendo activamente estudiado en su relación con la fisiopatología de la VHA (10).
Diagnóstico
El diagnóstico, en una primera etapa, es clínico y se basa en la búsqueda de síntomas característicos: urgencia miccional, habitualmente asociado a aumento de la frecuencia miccional diurna y/o nocturna y que puede o no estar acompañado de urge incontinencia. Se deben excluir otras causas de síntomas irritativos del tracto urinario inferior (como infección urinaria) y patologías neurológicas. Las pacientes que presentan hematuria o dolor referido a la vejiga requieren otro algoritmo diagnóstico.
Es recomendable evaluar una adecuada función miccional (ya sea mediante interrogatorio dirigido, uroflujometria o medición de residuo post miccional). La cartilla miccional, en sus diferentes formatos, corresponde a una herramienta especialmente valiosa en esta etapa ya que consigue objetivar frecuencia y volúmenes miccionales.
El examen físico general y genital debe ser realizado en cada mujer que consulta por IU. Este debe evaluar la presencia de globo vesical, defectos de soporte del Piso Pélvico, en especial del compartimiento anterior (prolapso vesical), hipermovilidad uretral, escape de orina con esfuerzos u otros hallazgos. Los signos de genitales de Síndrome Urogenital de la Menopausia (antiguamente llamados atrofia urogenital) también deben ser buscados y registrados, la urgencia que forma parte de este síndrome, presenta buena respuesta al uso de estriol tópico. El examen genital femenino debe ser realizado por el médico que asumirá el manejo de una mujer incontinente como parte de la consulta clínica.
En pacientes con sintomatología atípica, en casos de sospecha de disfunción del vaciado, en pacientes con antecedentes neurológicos o en caso de fracaso con el tratamiento de primera línea, estaría indicado el uso de exámenes complementarios como ecografía, cistoscopia y/o estudio urodinámico. Este último, si bien se considera el mejor método de estudio funcional de la vía urinaria inferior, presenta alta variabilidad en sus resultados y limitada correlación con respuesta terapéutica en SVH (11).
El uso de encuestas validadas que cuantifiquen los síntomas, así como su impacto en la calidad de vida, se recomienda como una herramienta muy valiosa tanto en el diagnostico como para evaluar la respuesta terapéutica y realizar seguimiento.
Tratamiento
Dentro de las alternativas terapéuticas se encuentran la modificación de hábitos y conductas, la fisioterapia de piso pélvico, los fármacos orales, la inyección cistoscópica de toxina botulínica, la neuromodulación sacra y la cirugía de ampliación vesical. Debido a la diversidad de manifestaciones clínicas, no existe un tratamiento estándar para este cuadro clínico y se recomienda adaptarlo a cada paciente en particular de forma escalonada y progresiva.
La restricción de ingesta de irritantes vesicales, la disminución de la ingesta de líquidos y la micción programada son medidas eficaces y seguras (12). La fisioterapia y la modificación de hábitos y conductas, han ido tomando cada vez más relevancia en la práctica clínica. La ICS sugiere su uso como primera línea de tratamiento para incontinencia de orina, ya que produce una mejoría de los síntomas en un rango reportado de un 50 a un 80% de los casos. La Asociación Americana de Urología (AUA) y la Asociación Europea de Urología (EUA), por su parte, plantean que los cambios conductuales y entrenamiento de piso pélvico deben ser la terapia de primera línea en mujeres con SVH. (11). La neuromodulación tibial posterior, presentada en las guías como tratamiento de tercera línea, ha probado ser una valiosa herramienta terapéutica en sus diferentes esquemas: uso domiciliario con parches transcutaneos y uso por profesional entrenado con aguja percutánea (13).
Respecto a la terapia farmacológica, los fármacos antimuscarínicos han sido los más utilizados, logrando buenas tasas de respuesta (cercanas al 60%) pero con altas cifras de abandono debido a los efectos adversos que estos presentan. A nivel molecular esto se explica por la poca selectividad de los principios activos por los distintos tipos de receptores muscarínicos (cinco descritos al momento), siendo el receptor M3 el que tendría la mayor relevancia en la contracción del detrusor. Los fármacos Beta 3 Agonistas (Mirabegron) presentan menores tasas de efectos adversos, sin embargo, la adherencia al tratamiento sigue siendo un problema (48). Otras limitaciones del Mirabegron es su elevado costo y la falta de disponibilidad en muchos países.
La gama de fármacos antimuscarínicos incluye Oxibutinina, Darifenacina, Tolterodina, Cloruro de Trospio y Solifenacina. Considerando que en algunos lugares no se dispone de estas alternativas, es pertinente mencionar la utilidad de los antidepresivos tricíclicos como Imipramina y Amitriptilina, siempre teniendo presente su elevada tasa de efectos adversos, especialmente cardiológicos. Debido a las similares tasas de respuesta encontradas entre los fármacos antimuscarínicos y la diversidad de efectos adversos producidos (ej.: boca seca, constipación) se recomienda comenzar con alguna preparación de liberación prolongada y toma única por sobre las otras formulaciones. Se recomienda a la vez elegir cuidadosamente el fármaco, dependiendo de las características del paciente y evaluar los eventuales beneficios versus los efectos adversos. En caso de adecuada respuesta clínica, pero aparición de efectos adversos, se recomienda el manejo sintomático de estos, así como intentar disminuir la dosis del fármaco. Si los efectos adversos son importantes y difíciles de manejar o la respuesta sintomática no es satisfactoria, se sugiere cambiar por otro fármaco antes de escalar en la terapia. Es importante mencionar que si un principio activo no tuvo la respuesta esperada se debe suspender al momento de iniciar la terapia con otro principio, ya que la sumatoria de medicamentos tiende a potenciar la aparición e intensidad de efectos adversos.
Cuando las modificaciones conductuales y los fármacos orales no han alcanzado adecuado control sintomático, o los efectos adversos de estos impiden que se mantenga la terapia, algunos autores plantean el termino de Vejiga Hiperactiva Refractaria. En estos casos se recomienda evaluar alternativas como el uso de toxina botulínica, neuromodulación sacra, ampliación vesical o derivación urinaria.
• La toxina botulínica, desde los primeros reportes de su uso en Vejiga Neurogenica el año 2000 (14) y posteriormente en hiperactividad idiopática (15), ha ganado un rol progresivamente protagónico entre las alternativas terapéuticas en urología. La posibilidad de realizarse de forma ambulatoria, así como su tasa de respuesta clínica superior al 80% y la baja incidencia de complicaciones han masificado su uso. La AUA (16) recomienda ofrecer el uso de 100U de onabotulinumtoxinA como inyección en el detrusor a pacientes que estén dispuestos a monitorizar su residuo post miccional y a realizar auto cateterismo intermitente de ser necesario. EAU (11) recomienda su uso diluido hasta10ml en solución salina e inyectada utilizando un esquema de 20 sitios de 0,5ml. Reporta requerimiento de re inyección en rangos de 6 a 7,5 meses. Las complicaciones más frecuentes son bacteriuria con y sin síntomas de ITU y residuo post miccional elevado.
• La Neuromodulación Sacra es una técnica que envía estímulos eléctricos a una raíz espinal sacra para modular su patrón neurológico relacionado, en este caso, al SVH, aunque su uso también está aprobado en disfunción miccional no obstructiva y en Incontinencia Fecal. Su uso conlleva una reducción de los síntomas igual o superior al 50% en un 60% de los pacientes implantados a los 3 años (cita ICS standards). Tanto la guía AUA como EAU la recomiendan como tercera línea terapéutica.
• La ampliación vesical con uso de intestino corresponde a una cirugía de excepción en pacientes con SVH, considerada como cuarta línea terapéutica. Existen múltiples técnicas y segmentos intestinales utilizados, siendo la incisión bivalva con interposición de íleon detubulizado la más frecuente. Presenta tasas de re operación por obstrucción o dehiscencia de la anastomosis intestinal entre 3 y 6%. Las complicaciones tardías incluyen disfunción de vaciado que pueden requerir cateterismo, formación de cálculos, perforación espontánea y alteraciones metabólicas (17).
El uso de estrógenos vaginales no está considerado en las guías clínicas. Sin embargo, su uso, a diferencia del uso de estrógenos sistémicos, ha demostrado una disminución en la sintomatología del SVH en mujeres post menopaúsicas (18). El perfil de seguridad del estriol utilizado por vía vaginal, en dosis de 3 aplicaciones semanales, permite ser indicado por el Urólogo. Su seguridad ha sido demostrada incluso en pacientes con Hiperplasia Endometrial (19) y en algunos estudios de pacientes con antecedente de cáncer de mama (20); no se recomienda utilizarlo en pacientes en tratamiento con inhibidores de la aromatasa (21).
Incontinencia urinaria de esfuerzos
Incontinencia de orina de esfuerzo (IUE) se refiere al escape de orina ante el esfuerzo o ejercicio o secundario a estornudos o tos (5). Corresponde a la patología de piso pélvico más prevalente y está presente en un 86% de las mujeres incontinentes, ya sea como síntoma único (50% de las mujeres incontinentes) o en asociación a urgeincontinencia, entidad clínica llamada incontinencia urinaria mixta (36% de las mujeres incontinentes) (4).
El principal factor de riesgo asociado a la IUE es la paridad. El riesgo se ve influenciado tanto por el número como por la vía de los partos. En relación a las nulíparas, las mujeres con antecedente de una o más cesáreas, presentan un OR de 1.5 (IC 1, 2-1, 9) y las que han tenido al menos un parto vaginal presentan un OR de 1.7 (IC 1, 3-2, 1) (22). Este fenómeno tiene su mayor impacto en las mujeres entre 20 y 40 años de edad y casi nulo impacto en mujeres sobre 65 años. En una encuesta noruega publicada el 2019 que incluyó a más de trece mil mujeres, las encuestadas menores de 50 años que habían tenido un parto con fórceps tuvieron mayor riesgo de presentar IUE en relación a las que habían tenido un parto vaginal no instrumental con OR de 1.42 (IC 1.09–1.86) y en relación a las que habían tenido un parto con vacum con OR de 1.76 (IC 1.20–2.60); no se encontró asociación entre el antecedente de tipo de parto e incontinencia de esfuerzo en el grupo de mujeres mayores de 50 años (23). El hipoestrogenismo y la obesidad son factores de riesgo modificables. Las mujeres con antecedentes de cirugía pelviana (como histerectomía, cirugía de prolapso, etc.) también presentan mayor riesgo de presentar incontinencia urinaria de esfuerzos.
Fisiopatología
Diferentes autores han intentado explicar, a lo largo de la historia, por qué ocurre la incontinencia de esfuerzo. Dentro de las teorías más destacadas encontramos:
- Transmisión de presiones: En los años sesenta, posterior a una serie de detalladas mediciones de la presión vesical y uretral durante la tos, Enhorning (24) postuló que la posición intraabdominal del cuello de la vejiga y de la uretra proximal eran un elemento necesario para la adecuada transmisión de la presión abdominal a estos segmentos (Figura 1). Además, postuló la hipótesis que el descenso de estos segmentos por debajo del diafragma urogenital los dejaría fuera del efecto protector de la transmisión de presiones causando la incontinencia de esfuerzo. Esta teoría justifica la colposuspensión de Burch como una alternativa terapéutica que reestablece la posición del cuello vesical y la uretra proximal.
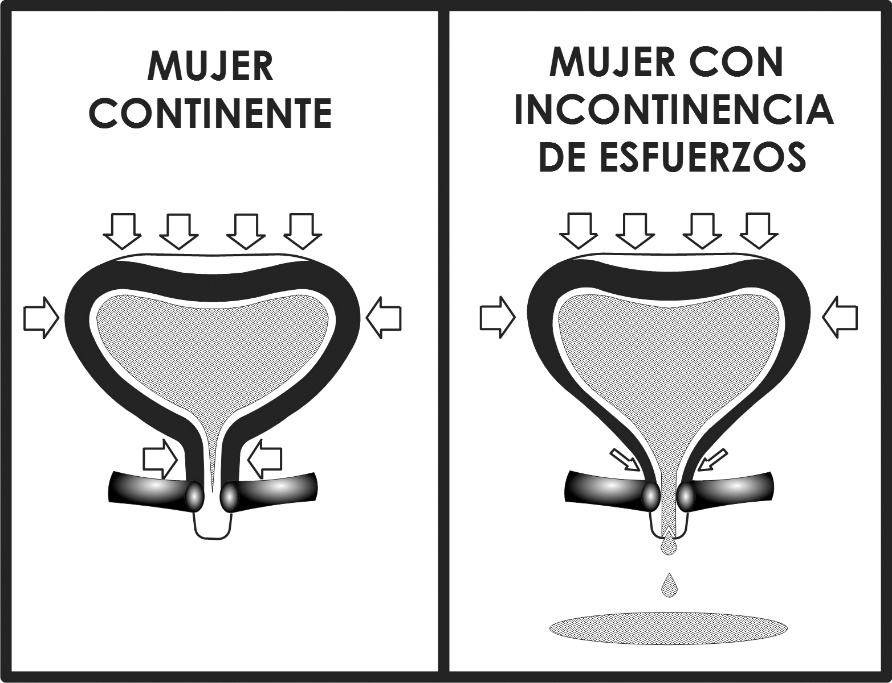

- Teoría integral de la continencia: Petros y Ulmsten, en la década de los noventa, reportaron un estudio vectorial de las presiones que determinan los fenómenos de continencia y micción, así como las estructuras involucradas en estos procesos. Definen a la uretra media, con su soporte fascial, muscular y vaginal (a la que llaman zona de elasticidad crítica), como la estructura responsable de la incontinencia de esfuerzos. Proponen entonces el refuerzo del soporte medio uretral mediante una malla de polipropileno, después de haber ensayado una serie de materiales con múltiples complicaciones (25).
Diagnóstico
La evaluación de una mujer incontinente se basa en el interrogatorio y el examen físico:
- Los elementos más significativos en la anamnesis de la IUE son: el escape de orina que se produce en relación a esfuerzos, actividad física, risa, tos, etc., la frecuencia miccional generalmente conservada y la ausencia de urgencia miccional (Tabla 1). Es recomendable cuantificar la magnitud del escape; frecuencia con la que ocurre y volumen de orina. El score de Sandvik (26) es fácil de utilizar, incluye solo dos preguntas y permite clasificar la gravedad de la Incontinencia en leve, moderada y severa. El impacto en la calidad de vida de la paciente debe ser registrado también. Tanto la gravedad de la IUE como su impacto en la calidad de vida son importantes elementos a considerar al momento de planificar una estrategia de tratamiento.
| INCONTINENCIA DE ESFUERZOS | INCONTINENCIA DE URGENCIA | |
| Ocurrencia | Día | Día / noche |
| Urgencia | No | Si |
| Frecuencia miccional diurna | Conservada | Aumentada |
| Frecuencia miccional nocturna | Conservada | Aumentada |
| Escape predecible | Si | No |
Tabla 1. Diagnóstico diferencial de la incontinencia urinaria en la mujer.
- Antecedentes como cirugías ginecológicas, cirugías previas por incontinencia de orina, actividad sexual, actividad física, habito intestinal, entre otros, también deben ser registrados y podrían influenciar el tratamiento propuesto.
- La cartilla miccional es una herramienta muy importante que permite evaluar frecuencia miccional y capacidad vesical; su realización se recomienda en toda paciente que consulta por incontinencia (11).
- El examen físico se realiza en la evaluación inicial, en posición de litotomía si se cuenta con mesa ginecológica o con las rodillas separadas y los pies juntos (posición de mariposa) en la mesa de examen simple. Se recomienda realizar el examen físico con la vejiga confortablemente llena. Es importante realizar una evaluación general del piso pélvico, con especial hincapié en la amplitud del hiato, la fuerza muscular de los músculos elevadores del ano y la presencia de defectos de soporte genital (prolapso). Se evalúa la movilidad de la uretra con maniobra de Valsalva y tos, ya sea en forma visual o con el uso de un cotonito (Q-tip test) y se objetiva la presencia de escape de orina durante Valsalva o Cough test. (Figura 2) Este momento representa una buena oportunidad para “ensayar” la cirugía que estoy pensando ofrecer. Si es una cinta suburetral libre de tensión se sugiere repetir las maniobras de Valsalva y tos con apoyo digital bajo la uretra media (27) (Video 1). Si el apoyo no obstructivo de la uretra media detiene el escape con Valsalva, se confirma la incontinencia de esfuerzos, se descarta clínicamente el daño esfinteriano intrínseco y se mantiene la indicación de cinta suburetral. Si la paciente relata escape con esfuerzos que no se logra reproducir durante el examen físico en posición ginecológica, se describen las siguientes alternativas; examinar en posición de pie, reevaluar con mayor volumen vesical, si existe prolapso genital reducirlo con pesario o equivalente y reexaminar, realizar Pad test posterior a la ingesta oral de fenazopiridina para confirmar escape de orina.
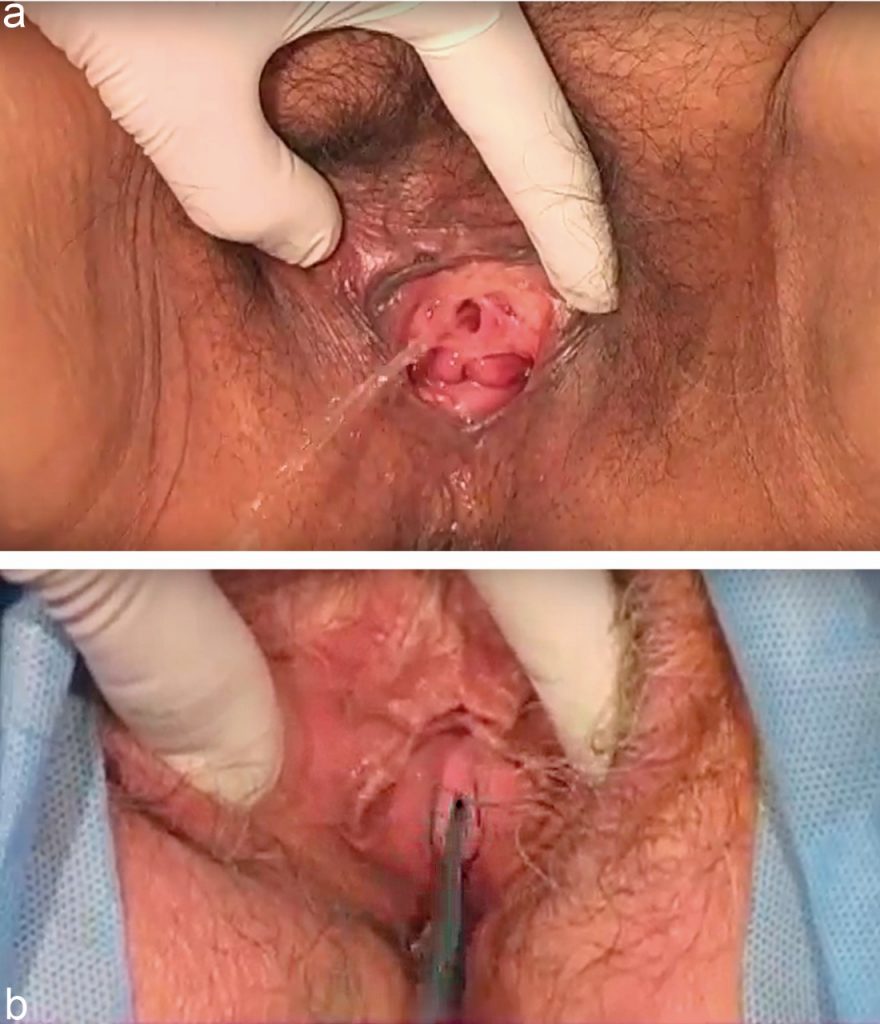

Son exámenes complementarios altamente recomendados: sedimento de orina con urocultivo, uroflujometría y medición de residuo postmiccional (esto especialmente en pacientes que optarán por alternativas quirúrgicas). Los casos complejos como imposibilidad de llegar a un diagnóstico con las herramientas clínicas descritas, fracaso de cirugías previas, síntomas mixtos con claro predominio de urgeincontinencia, sospecha de micción disfuncional, defectos anatómicos importantes del compartimiento anterior de la vagina (prolapso vesical), pueden requerir estudio complementario como cistometría simple, cistoscopia, estudio urodinámico (que se describe en otro capítulo) y/o estudio por imágenes.
La entidad llamada deficiencia esfinteriana intrínseca (DEI) fue definida urodinámicamente por McGuire (28) como un escape de orina a bajas presiones abdominales. Clínicamente se trata de pacientes que habitualmente presentan antecedentes mórbidos importantes como radioterapia, patología neurológica, cirugía pelviana previa, que relatan escape de orina con mínimos esfuerzos o en reposo, que al examen físico pierden orina con una uretra rígida y que no corrigen con maniobra de soporte sub uretral, requiriendo una cirugía de mayor soporte (o francamente obstructiva) y/o bajo el cuello vesical (Video 2, Video 3). Otras dos entidades que se deben tener presente ya que pueden “simular” una IOE son la vejiga hipoactiva con escape de orina sólo a grandes volúmenes y la hiperactividad idiopática gatillada por tos.
Tratamiento
Tratamiento no quirúrgico
- El tratamiento farmacológico pretende aumentar la efectividad del cierre uretral a través del aumento de la coaptación de la mucosa o el aumento del tono de los músculos liso y estriado. Si bien existen varias sustancias descritas como la Duloxetina y los estrógenos, su uso clínico ha sido limitado por su baja eficacia.
- La fisioterapia de piso pélvico, supervisada por un kinesiólogo(a) entrenado(a), debe indicarse como primera línea terapéutica. En mujeres seleccionadas también se pueden utilizar conos vaginales con peso graduado para estimular el entrenamiento muscular. La fisioterapia también se ha demostrado útil como medida de prevención de la incontinencia en puérperas desde la tercera semana postparto (11). Una de las principales limitaciones de esta terapia es la baja adherencia.
- El Yoga Hipopresivo, que mezcla la tradición y adherencia de una práctica milenaria (Hatha Yoga) con apneas espiratorias hipopresivas y ejercicios específicos para fortalecer el Piso Pélvico, ha demostrado resultados promisorios tanto en la prevención como en el manejo conservador de este tipo de disfunciones (29); su impacto clínico está siendo evaluado por una de las autoras. En una reciente revisión sistemática Cochrane, no se demostró beneficio de Yoga en Incontinencia de Orina (30). (Video 4)
- El uso de pesarios, artilugios médicos de diseño confeccionados para ocupar espacio en la vagina, ampliamente documentados como una buena alternativa mínimamente invasiva en el prolapso, también se ha descrito en el tratamiento de la incontinencia de orina de esfuerzo. Para este fin se han modificado incluyendo una zona de “soporte” uretral. Las candidatas ideales para este método serían mujeres embarazadas, ancianas o mujeres con elevado riesgo quirúrgico y pacientes que han fracasado con tratamiento quirúrgico. Las contraindicaciones corresponden a infección vaginal o pélvica activa, ulceración vaginal severa y pacientes que no podrán cumplir con el seguimiento. Las tasas de eficacia reportadas son extremadamente variables (31).
Tratamiento quirúrgico
Así como la fisiopatología de la incontinencia urinaria de esfuerzo no ha sido del todo establecida, la manera de solucionarla quirúrgicamente tampoco. Los conceptos de reestablecer el soporte de la uretra, elevar el cuello de la vejiga, reforzar la pared vaginal anterior y favorecer la compresión mecánica durante los aumentos de presión intra abdominal han originado diversas opciones de abordaje quirúrgico tanto por vía abdominal como por vía vaginal; las diversas opciones vigentes hoy en día reportan elevadas tasas de curación objetiva y subjetiva.
La selección de una alternativa quirúrgica por sobre las otras se basa en las características y expectativas de la paciente, las tasas de éxito y complicaciones del procedimiento, la disponibilidad de insumos y la destreza y entrenamiento del cirujano.
- Colposuspensión retro púbica de Burch
Históricamente ha sido una de las cirugías más frecuentemente realizadas y fue considerada como el gold estándar por largo tiempo. Se basa en la elevación de la uretra proximal y el cuello vesical mediante suturas que llevan el tejido paravaginal cercano a la uretra hacia el ligamento de Cooper. En una revisión sistemática realizada por la Sociedad Americana de Urología (32) la tasa de curación a 12-23 meses fue de 82% (abierta) y 69% (laparoscópica); a 24-47 meses fue de 74 a 76% para ambas técnicas; y a más de 4 años fue de 73%. La aparición de urge incontinencia de novo oscila entre el 8 y el 41% de las pacientes y la retención urinaria postoperatoria entre el 3 y el 4%. Es importante considerar que, de presentarse una obstrucción significativa, el tratamiento quirúrgico corresponde a uretrolisis por vía abdominal. Esto corresponde a una cirugía de mayor envergadura y riesgos en comparación con la sección de malla por vía vaginal, que sería la alternativa quirúrgica para una obstrucción post cinta sub uretral.
- Cintas suburetrales sintéticas libres de tensión (Figuras 3 y 4) (Video 5, Video 6)
Desde las primeras publicaciones de Petros y Ulmsten en 1993 con técnica retropúbicas (TVT) y con la posterior modificación propuesta por Delorme el 2001 con técnica transobturadora (TOT), las cintas suburetrales libres de tensión se han tornado en el método quirúrgico más utilizado para la corrección de la IUE. Diversos materiales han pretendido reforzar el soporte de la zona media de la uretra, siendo aceptado hoy en día las mallas tipo 1 como los insumos con menos efectos adversos (33). Entre sus ventajas destaca ser un procedimiento sencillo, mínimamente invasivo y con posibilidad de ser realizado de forma ambulatoria.



Los resultados de ambas técnicas, retropúbica y transobturadora, son en general equivalentes con curación objetiva a 4 años cercana al 80%. La tasa de curación, según algunos metaanálisis, sería levemente más alta para retropúbicos, pero la tasa de satisfacción de las pacientes sería similar (34).
La última revisión sistemática Cochrane reporta tasas de curación a un año de 71% a 97% para TVT y de 62% a 98% para TOT. En series de más de 5 años de seguimiento, las tasas de curación son más bajas, con curación subjetiva entre 43% y 92% para mujeres operadas de TOT y entre 51% al 88% para las operadas de TVT (35). Por otro lado, la serie con técnica retro púbica con mayor seguimiento publicada, de 17 años, reporta curación subjetiva en un 87% a 90% (36).
En términos generales, las complicaciones asociadas a ambas técnicas son menores al 10%. Las cintas retro púbicas se asocian a mayores tasas de perforación de vejiga, lesión vascular, disfunción miccional y riesgo de re operación por micción obstructiva (37) Por otro lado, para la técnica trans obturadora, hubo mayor dolor inguinal, necesidad de reoperación por recidiva de la incontienencia y dispareunia de novo (38)
En pacientes con diagnóstico de daño esfinteriano intrínseco las cintas retro púbicas serían más efectivas que las trans obturadoras, con curación cercana al 80% (39).
Vale la pena destacar dos elementos que a criterio de los autores juegan un rol importante en el éxito quirúrgico: la posición y la regulación de la tensión de la malla. Respecto a este último punto se han descrito métodos mecánicos como dejar una cantidad de malla que permita hacer un pliegue bajo la uretra, o dejar el espacio para que pase una tijera de Mayo. Desde la descripción de Mac Millan el año 2003 (40), en algunos centros se regula la tensión de la malla según el punto de presión de fuga intraoperatoria de 35 cm de agua con volumen vesical de 300ml, bajo anestesia raquídea (Video 7). Existe un protocolo multicéntrico en curso para validar este método de regulación.
- Mini- slings
Se han descrito diversas técnicas que se realizan mediante incisión única y sin el pasaje de la malla a través de la fascia endopelvica o membrana obturadora. Esto con el objetivo de reducir las complicaciones.
La revisión Cochrane de 2017 (41) evaluó la evidencia disponible con diferentes dispositivos como TVT‐Secur (retirado del mercado), MiniArc, Ajust, Needleless, Ophira, Tissue Fixation System, y CureMesh, y demostró que las pacientes tienen mayor probabilidad de permanecer incontinentes después de la cirugía con dispositivos de incisión única en relación al uso de cintas retro púbicas y también en relación a cintas trans obturadoras. Además, se observó que los mini sling presentaban mayor exposición de malla, mayor erosión vesical y uretral, tenesmo de novo y pérdida sanguínea.
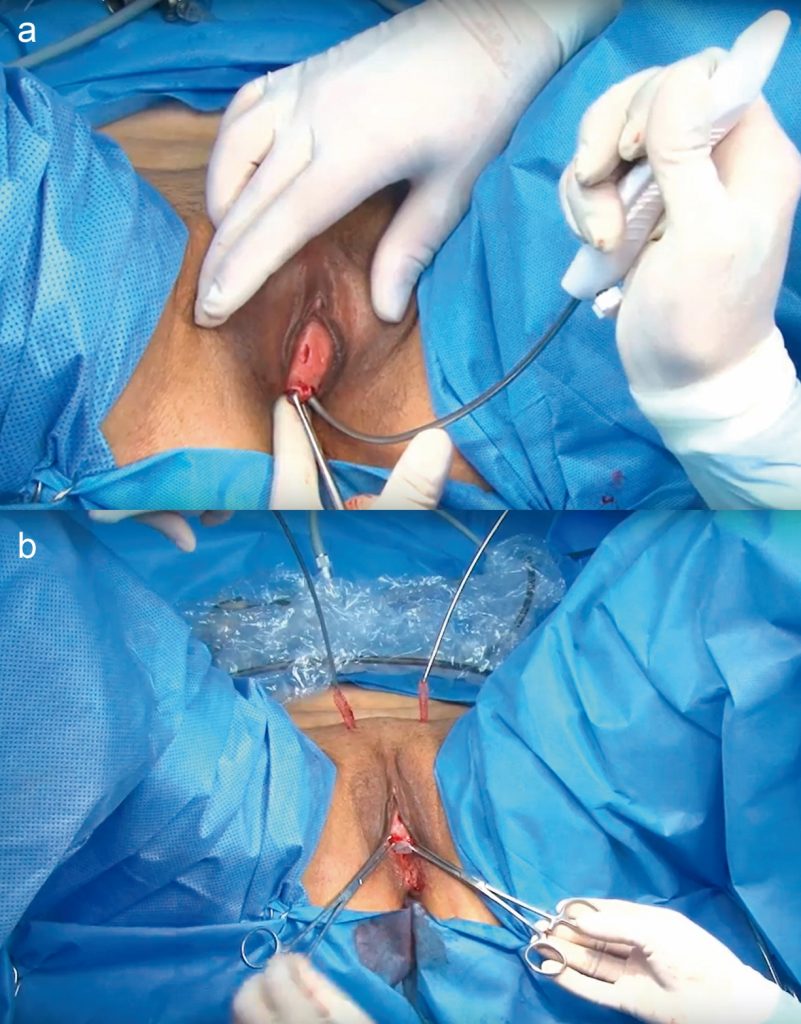
- Sling de fascia autóloga (Figuras 5a y 5b) (Video 8, Video 9)
Tanto la aponeurosis de los músculos rectos del abdomen como la fascia lata pueden ser utilizados por vía vaginal para dar soporte, habitualmente a nivel de la uretra proximal. Es una técnica más laboriosa, y con mayores complicaciones obstructivas en relación a las cintas sintéticas sin tensión. Sus principales indicaciones son pacientes con incontinencia severa con uretra fija o daño esfinteriano intrínseco, aquellas que requieren reconstrucción uretral concomitante, pacientes con recidivas de incontinencia que tuvieron alguna complicación por el material sintético y pacientes que no desean utilizar malla (42).
Las tasas de éxito descritas serian similares a sling sintéticos con cura subjetiva cercana al 85%, con menos complicaciones por cuerpo extraño. Se describen como eventos adversos disfunción miccional (10 a 14%) con necesidad de retiro de sling y cateterismo permanente, síntomas de vejiga hiperactiva de novo (3 a 18%), infección de heridas operatorias, perforación vesical durante cirugía, y otras menos frecuentes como erosión de sling, daño neurológico, fistula y disfunción sexual (43).
- Agentes de abultamiento (bulking agents)
Las inyecciones periuretrales de relleno son una alternativa menos invasiva y de bajo riesgo para mujeres que no son candidatas o desean diferir la cirugía. Las tasas de curación descritas a 5 años oscilan entre un 50% y un 70% (44).


Tiempo suprapúbico: a) Extracción de la cinta de fascia mediante una incisión suprapúbica. b) La cinta mide 2 cm de ancho por 8 cm de largo. c) cierre del defecto aponeurótico.


Tiempo Vaginal: a) Hidrodisección vaginal anterior, el punto azul marca la referencia del cuello vesical. b) Incisión vaginal en forma de U invertida. c) Perforación de la fascia Endopélvica del lado derecho de la paciente. d) Traspaso de las suturas irreabsorbibles que guían la cinta de fascia desde la vagina al espacio suprapúbico e) Se anudan ambas suturas irreabsorbibles, la izquierda y la derecha f) Posición final de la cinta, se fija a la fascia vesicovaginal con cuatro puntos de material reabsorbible (optativo).
Consideraciones en el Tratamiento de la incontinencia urinaria mixta (IOM)
El escape involuntario de orina asociado tanto a apremio miccional como a esfuerzos risa o tos corresponde a incontinencia urinaria mixta (IOM). Las estrategias de tratamiento habitualmente requieren abordar ambos aspectos de la fisiopatología. El orden cronológico en que se programen estas terapias debiera basarse en el componente que molesta mayormente a la paciente y debiese considerar las alternativas menos invasivas primero. Especial relevancia tienen en este grupo las modificaciones conductuales y fisioterapia de piso pélvico.
Para el tratamiento del componente de esfuerzos de la IOM se pueden usar cintas medio uretrales con un buen perfil de seguridad; en estos casos la exacerbación de síntomas de urgencia es más baja para TOT que para TVT (45), sin embargo, la tasa de reparación por persistencia del componente de esfuerzos es más elevada para TOT. Un estudio publicado en 2019 (46) reportó que TVT se asoció a un 85% de mejoría de los síntomas de incontinencia urinaria de esfuerzo en pacientes con IOM y solo un 5% presentó empeoramiento de los síntomas de urgencia. Además, la adición de fisioterapia peri operatoria mejoro los resultados referentes a frecuencia urinaria y síntomas relacionados con la urgencia a los 12 meses.
En una revisión sistemática del año 2011 (47) que evaluó el resultado de la cirugía de cinta medio uretral, las mujeres con incontinencia mixta tuvieron tasas de curación más bajas en comparación con las mujeres con IUE (56% versus 85 a 97%). Es importante considerar estas cifras para una adecuada consejería pre operatoria en mujeres con Incontinencia Mixta.
Bibliografía
1. Chiang H., Landerer E., et al. Estandarización de la terminología de la función del tracto urinario inferior: reporte del subcomité de estandarización de la International Continence Society. Rev Chil Urol 2006; 71:2.
2. Haylen BT, de Ridder D. “An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction.” Neurourol Urodyn. 2010;29(1):4
3. Coyne KS, Sexton CC, Irwin DE, Kopp ZS, Kelleher CJ, Milsom I. The impact of overactive bladder, incontinence and other lower urinary tract symptoms on quality of life, work productivity, sexuality and emotional well-being in men and women: results from the EPIC study. BJU Int. 2008 Jun;101(11):1388–95
4. Ford AA, Rogerson L, Cody JD, Ogah J, “Mid-urethral sling operations for stress urinary incontinence in women” Cochrane Database of Systematic Reviews 2015, Issue 7. Art. No.: CD006375 review 2017
5. Hunskaar S., Lose G., Sykes D., Voss S. The prevalence of urinary incontinence in women in four european countries. BJU Int. 2004: 93(3):324-30.
6. Abrams P., Cardozo L., Fall M., et al. The standardisation of terminology of lower urinary tract function: Report from the Standardisation Subcommittee of the International Continence Society. Neurourol Urodyn 2002; 21:167-78
7. Wei J., De Lancey J. Functional anatomy of the pelvic floor and lower urinary tract. Clin Obstet Gynecol 2004; 47(1):3-17.
8. Szabo, S. M., Gooch, K. L., Walker, D. R., Johnston, K. M., & Wagg, A. S. (2018). The Association Between Overactive Bladder and Falls and Fractures: A Systematic Review. Advances in Therapy, 35(11), 1831–1841. doi: 10.1007/s12325-018-0796-8.
9. Brading A. A myogenic basis for the overactive bladder. Urology 50(Suppl 6A) 1997:57-67.
10. De Groat, W. C. D., & Yoshimura, N. (2015). Anatomy and physiology of the lower urinary tract. Neurology of Sexual and Bladder Disorders Handbook of Clinical Neurology, 61–108. doi: 10.1016/b978-0-444-63247-0.00005-5
11. EAU guideline Urinary Incontinence https://uroweb.org/guideline/urinary-incontinence/#3
12. Wood, L. N., Markowitz, M. A., Parameshwar, P. S., Hannemann, A. J., Ogawa, S. L., Anger, J. T., & Eilber, K. S. (2018). Is it Safe to Reduce Water Intake in the Overactive Bladder Population? A Systematic Review. Journal of Urology, 200(2), 375–381. doi: 10.1016/j.juro.2018.02.3089
13. Manríquez, V., Guzmán, R., Naser, M., Aguilera, A., Narvaez, S., Castro, A., … Digesu, G. A. (2016). Transcutaneous posterior tibial nerve stimulation versus extended release oxybutynin in overactive bladder patients. A prospective randomized trial. European Journal of Obstetrics & Gynecology and Reproductive Biology, 196, 6–10. doi: 10.1016/j.ejogrb.2015.09.020
14. Schurch, B., Stohrer, M., Kramer, G., Schmid, D. M., Gaul, G., & Hauri, D. (2000). Botulinum-A Toxin For Treating Detrusor Hyperreflexia In Spinal Cord Injured Patients: A New Alternative To Anticholinergic Drugs? Preliminary Results. The Journal of Urology, 692–697. doi: 10.1097/00005392-200009010-00018
15. Schmid, D., Sauermann, P., Werner, M., Schuessler, B., Blick, N., Muentener, M., … Schurch, B. (2006). Experience With 100 Cases Treated With Botulinum-A Toxin Injections in the Detrusor Muscle for Idiopathic Overactive Bladder Syndrome Refractory to Anticholinergics. Journal of Urology, 176(1), 177–185. doi: 10.1016/s0022-5347(06)00590-8
16. Diagnosis and Treatment of Non-Neurogenic Overactive Bladder (OAB) in Adults: an AUA/SUFU Guideline (2019) Retrieved from https://www.auanet.org/Documents/Guidelines/PDF/Overactive-Bladder.pdf
17. Wadie, B. S. (2014). Management of Refractory OAB in the Non-Neurogenic Patient. Current Urology Reports, 15(9). doi: 10.1007/s11934-014-0438-x
18. Lethaby, A., Ayeleke, R. O., & Roberts, H. (2016). Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database of Systematic Reviews. doi: 10.1002/14651858.cd001500.pub3
19. Chow, S., et al. “Topical vaginal estrogen use and risk of endometrial hyperplasia or cancer.” Gynecologic Oncology 154.1 (2019): e30-e31.
20. Dew, J. E., B. G. Wren, and J. A. Eden. “A cohort study of topical vaginal estrogen therapy in women previously treated for breast cancer.” Climacteric 6.1 (2003): 45-52.
21. Kendall, A., et al. “Caution: vaginal estradiol appears to be contraindicated in postmenopausal women on adjuvant aromatase inhibitors.” Annals of oncology 17.4 (2006): 584-587.
22. Rortveit G., Daltveit A., Hannestad Y., Hunskaar S. Urinary incontinence after vaginal delivery or cesarean section. N Engl J Med. 2003; 6;348(10):900-7.
23. Tähtinen, R. M., Cartwright, R., Vernooij, R. W., Rortveit, G., Hunskaar, S., Guyatt, G. H., & Tikkinen, K. A. (2019). Long-term risks of stress and urgency urinary incontinence after different vaginal delivery modes. American Journal of Obstetrics and Gynecology, 220(2). doi: 10.1016/j.ajog.2018.10.034
24. Enhorning G. Simultaneous recording of the intravesical and intraurethral pressure. Acta Obstet Gynecol Scand 1961; 276:1–69.
25. Petros P., Ulmsten U. An integral theory and its method for the diagnosis and management of female urinary incontinence. Scand J Urol Nephrol 1993; 153:1-939.
26. Sandvik H, Hunskaar S, Seim A, Hermstad R, Vanvik A, Bratt H. Validation of a severity index in female urinary incontinence and its implementation in an epidemiological survey. J Epidemiol Community Health. 1993;47(6):497–499. doi:10.1136/jech.47.6.497
27. Mac Millan G., Yunge P., Daviú A. Incontinencia de Esfuerzo (IUE) en la mujer. Contribución a la comprensión de su patogenia y tratamiento. Revista Chilena de Urología, Volumen 68 /N 1 año 2003.
28. McGuire et al. Clinical assessment of urethral sphincter function. J Urol 1993; 150:1452-4.
29. Cavllari Y., Yoga Hipopresivo. 1° Edición. DDI A- 290388. ISBN 9789563938005. Valparaíso, Chile 2018.
30. Wieland, L. S., Shrestha, N., Lassi, Z. S., Panda, S., Chiaramonte, D., & Skoetz, N. (2019). Yoga for treating urinary incontinence in women. Cochrane Database of Systematic Reviews. doi: 10.1002/14651858.cd012668.pub2
31. Al-Shaikh, G., Syed, S., Osman, S., Bogis, A., & Al-Badr, A. (2018). Pessary use in stress urinary incontinence: a review of advantages, complications, patient satisfaction, and quality of life. International Journal of Womens Health, Volume 10, 195–201. doi: 10.2147/ijwh.s152616
32. American Urological Association Guidelines. Diagnosis and treatment of Overactive Bladder (No – Neurogenic) in Adults. AUA Guideline (2012)
33. Cosson M, Debodinance P, Boukerrou M et al (2003) Mechanical properties of synthetic implants used in the repair of prolapse and urinary incontinence in women: which is the ideal material. IntUrogynecol J 14:169–178
34. Schimpf M. Sling surgery for stress urinary incontinence in women: a systematic review and metaanalysis. Am J Obstet Gyneco 2014; 211(1):e1-71 e27
35. Ford AA, Rogerson L, Cody JD, Ogah J, “Mid-urethral sling operations for stress urinary incontinence in women” Cochrane Database of Systematic Reviews 2015, Issue 7. Art. No.: CD006375 review 2017
36. Tension-free vaginal tape for treatment of pure urodynamic stress urinary incontinence: efficacy and adverse effects at 17-year follow-up. Braga A, Caccia G, Sorice P, Cantaluppi S, Coluccia AC, Di Dedda MC, Regusci L, Ghezzi F, Uccella S, Serati M , BJU Int. 2018;122(1):113. Epub 2018 Feb 22.
37. Reoperation for Urinary Incontinence After Retropubic and Transobturator Sling Procedures. Trabuco EC, Carranza D, El Nashar SA, Weaver AL, McGree ME, Elliott DS, Linder BJ, Occhino J, Gebhart JB, Klingele CJ Obstet Gynecol. 2019;134(2):333.
38. Dyspareunia associated with paraurethral banding in the transobturator sling. Cholhan HJ, Hutchings TB, Rooney KE .Am J Obstet Gynecol.
39. Retropubic or transobturator mid-urethral slings for intrinsic sphincter deficiency-related stress urinary incontinence in women: a systematic review and meta-analysis. Ford AA, Ogah JA . Int Urogynecol J. 2016 Jan;27(1):19-28. Epub 2015 Jul 29
40. MacMillan G, Yunge P, Daviú A, Riera P, Godoy M. Incontinencia urinaria de esfuerzo (IUE) en la mujer. Contribución a la comprensión de su patogenia y tratamiento. Rev Chil Urol 2003;68:51-4.
41. Nambiar A, Cody JD, Jeffery ST, Aluko P. Single‐incision sling operations for urinary incontinence in women. Cochrane Database of Systematic Reviews 2017, Issue 7. Art. No.: CD008709. DOI: 10.1002/14651858.CD008709.pub3.
42. Surgical management of lower urinary mesh perforation after mid-urethral polypropylene mesh sling: mesh excision, urinary tract reconstruction and concomitant pubovaginal sling with autologous rectus fascia. Shah K, Nikolavsky D, Gilsdorf D, Flynn BJ . Int Urogynecol J. 2013;24(12):2111.
43. S.Plagakis, V Tse. (2020). The autologous pubovaginal fascial sling: An update in 2019. Lower Urinary Tract Symptoms, 12, 2–7. DOI: 10.1111/luts.12281
44. Complications of urethral bulking therapy for female stress urinary incontinence. Kocjancic E, Mourad S, Acar Ö. Neurourol Urodyn. 2019 Aug;38 Suppl 4:S12-S20. doi: 10.1002/nau.23877
45. Welk, B., & Baverstock, R. J. (2017). The management of mixed urinary incontinence in women. Canadian Urological Association Journal, 11(6S2), 121. doi: 10.5489/cuaj.4584
46. Sung, V. W., Borello-France, D., Newman, D. K., Richter, H. E., Lukacz, E. S., Moalli, P., … Gantz, M. G. (2019). Effect of Behavioral and Pelvic Floor Muscle Therapy Combined With Surgery vs Surgery Alone on Incontinence Symptoms Among Women With Mixed Urinary Incontinence. Jama, 322(11), 1066. doi: 10.1001/jama.2019.12467
47. Effectiveness of midurethral slings in mixed urinary incontinence: a systematic review and meta-analysis. Jain P, Jirschele K, Botros SM, Latthe PM. Int Urogynecol J. 2011 Aug;22(8):923-32. Epub 2011 Apr 1.
