Capítulo 10
Síntomas del tracto urinario inferior en el hombre e hiperplasia prostática benigna
Introducción y nomenclatura
Clásicamente, los síntomas urinarios bajos en el hombre se consideraban como originados en la próstata, por lo que se agrupaban bajo el nombre de prostatismo y se clasificaban en irritativos y obstructivos. Sin embargo, estos síntomas no son exclusivos del sexo masculino, de la próstata ni de la obstrucción del tracto de salida. Además, esta nomenclatura conducía a una comprensión inapropiada de la fisiopatología y a resultados terapéuticos insatisfactorios1. Por todo lo anterior, es que en 1995 se adoptó una nueva terminología de consenso (International Consensus Conference on BPH in Monaco) la cual ha sido modificada desde entonces:
- Síntomas del tracto urinario inferior (STUI) o Lower Urinary Tract Symptoms (LUTS): corresponden a síntomas relacionados con el tracto urinario inferior, que se pueden originar en la vejiga, próstata, uretra, órganos vecinos y/o piso pélvico adyacente, pudiendo ocasionalmente ser referido desde estructuras con similar innervación (ej: uréter). La multiplicidad de orígenes, hace que sus causas sean igualmente variadas, tales como, obstrucción del tracto de salida vesical, infección, neoplasia, litiasis, vejiga neurogénica, poliuria renal, causas psicogénicas, uso de fármacos 2, etc.
- Síntomas de almacenamiento: LUTS que ocurren durante la fase de llenado de la vejiga. Reemplazan a los síntomas irritativos ya que esta denominación sugería la presencia de inflamación, que no es lo habitual en estos pacientes. Se incluyen aumento de frecuencia miccional, nocturia, urgencia, incontinencia y alteraciones de la sensibilidad vesical, entre otros.
- Síntomas de vaciamiento: LUTS que ocurren durante la fase de vaciado vesical o micción. Reemplazan a los síntomas obstructivos, dado que la obstrucción del tracto de salida no siempre está presente, pudiendo verse en hipoactividad del detrusor. Comprenden el flujo miccional débil, latencia, disuria de esfuerzo, intermitencia, goteo terminal, retención de orina y hematuria, entre otros.
- Síntomas postmiccionales: LUTS presentes al fin de la micción. Incluye la sensación de vaciamiento vesical incompleto y goteo post miccional.
- Hiperplasia prostática benigna (HPB): describe un patrón histológico característico, que, si bien está presente en 70% de los hombres mayores de 70 años, sólo la mitad de ellos tienen la próstata aumentada de volumen y sólo un 25% manifiestan LUTS.
- Crecimiento prostático benigno (CPB): alude al aumento del volumen prostático pesquisado al tacto rectal o imágenes.
- Obstrucción al tracto de salida vesical o Bladder Outlet Obstruction (BOO): corresponde al diagnóstico urodinámico de obstrucción al vaciamiento vesical, caracterizado por un aumento anormal de presión del detrusor, asociado a un chorro miccional anormalmente disminuido. Puede tener múltiples causas, tales como estenosis de cuello vesical, hiperplasia de la próstata, estenosis uretral o de meato uretral, etc.
- Obstrucción prostática benigna: es la BOO secundaria a CPB.
- Vejiga hiperactiva u Overactive Bladder (OAB): es el diagnóstico clínico de urgencia, con o sin urgeincontinencia, que puede o no ser confirmado por cistometría como hiperactividad del detrusor.
- Hiperactividad del detrusor: diagnóstico urodinámico establecido por la presencia de contracciones del detrusor durante la cistometría de llenado. Puede o no asociarse a síntomas como urgencia y urge-incontinencia.
Epidemiología de LUTS
Estudios poblacionales han demostrado una prevalencia de LUTS moderados a severos de 16 – 52%. Estos son más frecuentes en hombres y hay un aumento de la prevalencia junto con la edad. Hay que considerar que los estudios de prevalencia poblacionales pueden estar sobrestimando el problema, ya que solo el 50% de los pacientes que reporta la presencia de estos síntomas, refiere que estos le generan algún grado de incomodidad.
En un estudio realizado por la International Continence Society se observó que los LUTS de vaciado (90-94%) eran más frecuentes que los de llenado (66-71%), pero que estos últimos eran más incomodos para los pacientes. Además, se identificó el goteo terminal como el síntoma más frecuente (96%). 3
La presencia de LUTS leves generan escaso impacto en la calidad de vida, pero en los casos severos el impacto en calidad de vida es similar al generado por un IAM o ACV. 4
Múltiples factores de riesgo se han asociado al desarrollo y exacerbación de los LUTS, dentro de los cuales encontramos a la diabetes mellitus, enfermedad cardiovascular, síndrome metabólico, envejecimiento obesidad, sedentarismo y disfunción eréctil. 5,6
Etiología de los LUTS
Como se discutió previamente, los LUTS carecen de especificidad, pudiendo ser la manifestación de una extensa variedad de patologías diferentes (ver gráfico 1) e incluso, en un mismo paciente, pueden coexistir más de una causa que expliquen los síntomas.

El CPB tiene un conocido rol en el desarrollo y progresión de los LUTS, pero es muy probable que los factores que conducen al desarrollo de éste también tengan un impacto en otros aspectos de la función del tracto urinario inferior.
Epidemiología HPB
La HPB es una alteración frecuente en el hombre, cuya prevalencia aumenta junto con la edad. Si se considera la HPB histológica, su prevalencia crece desde un 8% en hombres entre 31 y 40 años, 40-50% entre 51 y 60 años, y sobre 80% en mayores de 80 años 7. El incremento en la expectativa de vida hace aún más importante esta condición del hombre mayor, desde el punto de vista epidemiológico. Tiene un impacto negativo significativo en la calidad de vida de las personas afectadas. La mortalidad es rara, estimándose en 0.5-1.5/100.000 para países desarrollados en los años 80, según la OMS 8. La historia familiar tiene significancia, ya que se ve más HPB en hombres cuyos padres tuvieron cirugía prostática antes de los 50 años 9. No hay estudios de prevalencia nacionales, pero en la actualidad representa la segunda causa de egresos hospitalarios por patología genitourinaria en hombres en Chile.
Etiología HPB
En la HPB se produce una proliferación benigna estromal (fibroblastos y miofibroblastos) y epitelial de la zona transicional. Es iniciada hacia la cuarta década de vida, con pequeños nódulos hiperplásicos, y con un mayor desarrollo hacia la sexta década. Éstos pueden crear grados variables de obstrucción.
La etiología persiste parcialmente desconocida. Se ha propuesto la existencia de reactivación de procesos embrionarios 10. Lo que podría estar desencadenado por una combinación de factores, tales como andrógenos, estrógenos, interacciones estromales-epiteliales, factores de crecimientos y neurotransmisores.
- Andrógenos: son necesarios para el crecimiento y desarrollo prostático, teniendo un rol importante en la proliferación e inhibición de la apoptosis de células prostáticas. En individuos castrados previo a la pubertad y en pacientes con alteración de la producción de testosterona y falla de su receptor, no hay desarrollo de HPB 11. Sin embargo, solo tienen un rol permisivo en la HPB. Los niveles de andrógeno prostáticos no son significativamente distintos en HPB ni en tejidos normales, ni tienen mayor incidencia de HPB los hombres con terapia androgénica suplementaria 12.
- Estrógenos o un desbalance andrógeno/estrógeno: podrían ser significativos, apoyados en dos observaciones. Primero, la relación testosterona/estradiol disminuye sostenidamente en el hombre envejeciendo 13. En segundo lugar, la modificación experimental de niveles de estradiol en animales puede producir HPB 14. También se ha observado relación entre obesidad y HPB, que podría representar el desbalance estrógeno/testosterona visto en obesos, resultante del aumento de la aromatización periférica de la testosterona.
- Inflamación: la inflamación prostática es una característica común de las próstatas adultas. Estudios in vivo e in vitro han identificado complejas redes de citoquinas y factores de crecimientos involucradas en la inflamación prostática. Este proceso inflamatorio lleva a daño tisular y un proceso de reparación crónico, que estimularía en forma persistente a las células prostáticas estromales y epiteliales 15. La biopsia prostática de 8224 hombres participando del ensayo Reduction by Dutasteride of prostate Cancer Events-REDUCE mostró inflamación en más de tres cuartos de las muestras. La inflamación también se correlacionó con progresión sintomática, riesgo de retención urinaria y necesidad de cirugía 16. El origen de la inflamación prostática es probablemente multifactorial. Hay evidencia de reflujo urinario hacia los conductos prostáticos, y son comunes la colonización e infección bacteriana en muestras prostáticas quirúrgicas, aún con orina preoperatoria estéril. Otras causas de inflamación son mecanismos autoinmunes, stress oxidativo, constituyentes dietarios nocivos e inflamación sistémica asociada al síndrome metabólico 17.
También se ha asociado el síndrome metabólico al desarrollo y progresión de HPB. se ha identificado una correlación entre CPB e índice de masa corporal 18. El mecanismo sería la mayor tasa de aromatización de la testosterona, inflamación tisular y estrés oxidativo asociados a la obesidad. Otros estudios muestran que los hombres con HPB tienen mayor incidencia de diabetes mellitus que la población general y que se asocia con LUTS más severos 19.
Fisiopatología
El CPB determina un aumento de la resistencia uretral mediado por un componente estático (aumento de volumen) y un componente dinámico (aumento del tono muscular liso). Considerar, que el tamaño prostático no se correlaciona necesariamente con la presencia de obstrucción, existiendo otros factores que tendrían mayor relevancia, tales como el componente dinámico, las variaciones anatómicas y la cápsula prostática.
El aumento de la resistencia en el tracto de salida vesical lleva al desarrollo de una hipertrofia vesical compensadora (aumento de músculo y colágeno), que permite un vaciado completo. Los cambios descritos se asocian a alteraciones celulares musculares y de la matriz extracelular, que causan hiperactividad y alteración de la contractilidad vesical. Estas modificaciones vesicales, asociados a los cambios propios de la edad que ocurren en vejiga y sistema nervioso, determinan la aparición de LUTS. Eventualmente, el aumento de presión que genera esta forma de compensación no será suficiente para permitir un vaciado vesical completo, con aparición de residuo vesical patológico y dilatación vesical con alteración de la capacidad contráctil de la vejiga.
La duración de la fase de compensación es variable. En general, existe una tendencia general de deterioro de LUTS y HPB con el tiempo, donde factores como edad, severidad de síntomas, flujo máximo < 10ml/s, tamaño prostático >30ml y APE > 1.6 ng/ml, serían predictores de progresión de la enfermedad y de requerir tratamiento quirugico20. El volumen prostático (VP) es quizás el factor más estudiado como riesgo de progresión de la HPB. Los hombres con VP >30ml tienen 3,5 veces mayor probabilidad de tener síntomas moderados a severos, 2,5 veces de tener flujo disminuido y 3-4 veces mayor probabilidad de retención aguda de orina, respecto a los con VP <30ml21.
Las complicaciones que pueden originarse son la infección urinaria, litiasis vesical, hematuria, insuficiencia renal post-renal y retención urinaria.
Evaluación clínica
La HPB se hace clínicamente relevante si se asocia a LUTS molestos. Sin embargo, no todos los hombres con HPB tienen LUTS, y algunos pacientes con LUTS no tienen HPB. La evaluación clínica tiene dos objetivos principales:
- Establecer la severidad de los síntomas y descartar diagnósticos diferenciales de LUTS.
- Identificar a los pacientes con riesgo de progresión rápida y de complicaciones, que pudieran beneficiase de un tratamiento precoz.
Historia:
La historia busca identificar la presencia de potenciales causas y comorbilidades relevantes, considerando causas médicas, quirúrgicas, neurológicas, farmacológicas, hábitos, etc.
Las guías EAU 2019, AUA 2019 y NICE 2015 recomiendan el uso de un cuestionario estandarizado. El IPSS (International Prostate Symptom Score) permite definir severidad de los síntomas y evaluar respuesta al tratamiento, pero no tiene valor diagnóstico ni se correlaciona con grado de obstrucción. Este score consiste en siete preguntas sobre síntomas miccionales, que otorgan puntaje final de 0-35 y establecen categorías de sintomatología: 0-7 leve, 8-19 moderada, 20-35 severa. Una octava pregunta indaga sobre la calidad de vida. Puede ser autoaplicado o integrado a la consulta.
Las cartillas miccionales registran horario y volumen de cada micción, en 3-7 días. Es particularmente útil en pacientes con nicturia y/o síntomas de vaciado.
Examen físico:
Las guías EAU 2019 y NICE 2015 recomiendan realizar un examen físico abdominal, genital y con tacto rectal. Hay que considerar que el tacto rectal no tiene buena correlación con el tamaño prostático, sin embargo, suele ser posible establecer la diferencia entre próstatas mayores y menores de 50 g. Considerar examen neurológico en pacientes seleccionados22.
Laboratorio:
Se recomienda realizar un estudio básico no invasivo en todos los pacientes, reservando estudios adicionales para casos con duda diagnóstica o previo a resolución quirúrgica.
El estudio puede considerar:
- Examen de orina: es útil para la detección de infección urinaria, hematuria, glucosuria, proteinuria, cilindros.
Recomendado por las guías EAU 2019, AUA 2019 y NICE 2015 como parte del estudio rutinario. - Antígeno prostático específico (APE): existen dos potenciales razones para solicitarlo. En primer lugar, como screening de cáncer de próstata (ver discusión en capitulo correspondiente). En segundo lugar, porque tiene valor en la predicción de progresión y respuesta a tratamiento. En ausencia de cáncer, el APE se relaciona con el tamaño prostático. Para detectar hombres con próstata mayores de 40 ml, se consideran valores de APE >1.6, >2.0 y >2.3 ng/ml para hombres con HPB y edad >50, >60 y >70 años, respectivamente23. Además, el APE se relaciona predice el cambio de sintomatología, calidad de vida, flujo máximo urinario, progresión clínica, riesgo de retención urinaria y necesidad de cirugía24 25 26.
La guía EAU 2019 recomienda solicitarlo en paciente donde el diagnóstico de cáncer prostático modifica la conducta y en pacientes donde el APE ayude en la definición de tratamiento. La guía AUA 2019 no establece recomendación. La guía NICE 2015 recomienda solicitarlo en caso de sospecha de cáncer prostático y cuando los LUTS son sugerentes de HPB. - Creatininemia: su aumento puede ser secundaria a una obstrucción del tracto de salida o a una enfermedad renal subyacente.
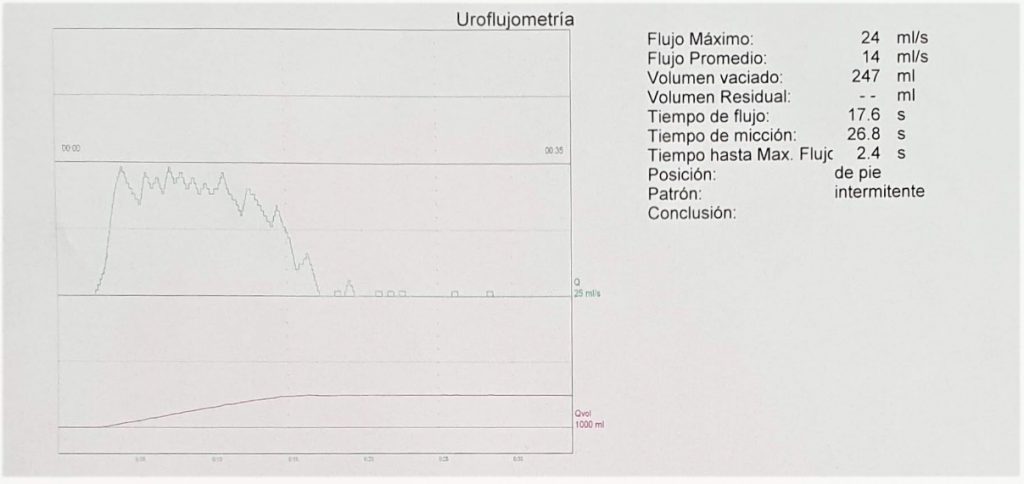
Su uso rutinario no es recomendado por la guía AUA 2019, mientras que las guías EAU 2019 y NICE 2015 recomiendan su evaluación en casos seleccionados según sintomatología y presencia de diabetes e hipertensión. Si está elevada, se recomienda ecotomografía urinaria. - Uroflujometría: es un estudio no invasivo que permite la evaluación y cuantificación de la micción basal y durante el seguimiento. Los parámetros más relevantes que informa son el volumen orinado, el flujo máximo (Qmax) y la forma de la curva. Para evitar variabilidad en los flujos reportados, se debe contar con un volumen orinado >150 ml. En general, se acepta que un Qmax <10 ml/s indica alta probabilidad de obstrucción y que un Qmax >15 ml/s indica baja probabilidad de obstrucción. La forma de la curva puede orientar en la etiología que este causando la alteración del flujo. La presencia de un Qmax >15 ml/s asociado a una curva en forma de campana indica la presencia de micción normal. Sin embargo, la uroflujometría no es capaz de discriminar si el mecanismo que altera el flujo es obstructivo o por alteración de la contractilidad vesical. En un estudio de hombres con síntomas obstructivos y medición de Qmax, el estudio flujo/presión detectó que sólo un 5% de los individuos con Qmax <12ml/seg no estaban obstruidos27. En hombres con BPO, aquellos con Qmax <10ml/seg tienen un mejor resultado postoperatorio que los con mayor flujo28.
Las guías EAU 2019 y AUA 2019 recomiendan su realización previa a tratamiento quirúrgico. Adicionalmente la guía EAU 2019 recomienda débilmente su realización en la evaluación inicial. La guía NICE 2015 recomiendan su uso en la evaluación por especialista.
A continuación se muestran tres ejemplos de UFM:





- Orina residual postmicción (RPM): se puede determinar mediante cateterismo o ecografía. Su alteración puede ser secundaria a una obstrucción del tracto de salida, pero también a un detrusor hipoactivo. No existe un consenso claro respecto de los valores de corte para establecer un RPM patológico, habiéndose utilizado como puntos de corte: >50 ml, >200 ml, 10-20% de la capacidad funcional vesical. En la actualidad, existe escasa evidencia que apoye la relación entre RPM elevado y retención aguda de orina29, infección urinaria y necesidad de cirugía. Un estudio del Veterans Administration que comparó RTU y observación en 566 hombres con síntomas moderados de HPB, demostró que el volumen de orina residual no era predictor del resultado quirúrgico30.
Su medición es recomendada solo en la evaluación por especialista en la guía NICE 2015, la guía AUA recomienda medirlo previo a resolución quirúrgica y la guía EAU 2019 recomiendan de forma débil su realización. - Estudio flujo presión: si bien es el Gold Standard para el diagnóstico de obstrucción al tracto de salida, su uso se reserva para casos en que existe duda diagnóstica, ya que es un estudio invasivo y costoso.
Las guías EAU 2019 y AUA 2019 sugieren su realización en casos seleccionados. La guía NICE 2015 sugiere considerar realizarlo previo a la resolución quirúrgica.
Imágenes:
- Evaluación de vía urinaria superior: dado que los pacientes con LUTS no presentan mayor frecuencia de alteraciones en vía urinaria superior31, solo estaría recomendada en casos seleccionados.
La guía AUA 2019 no establece recomendación especifica. La guía EAU 2019 recomienda débilmente el uso de ecografía renal en pacientes con RPM elevado, hematuria e historia de urolitiasis. La guía NICE 2015 recomienda solicitar imagen de vía urinaria superior en pacientes con retención crónica de orina, hematuria, infección recurrente, piuria estéril, síntomas severos y dolor. - Ecografía de próstata: tiene como objetivo principal la evaluación del tamaño prostático que influenciará la opción de tratamiento médico y quirúrgico. Esta medición se puede realizar por vía transabdominal y transrectal, siendo esta última la que aporta mediciones más confiables. En pacientes operados vía abierta, la ecografía transrectal preoperatoria subestimó en 4.4% el peso prostático vs una sobreestimación del 55.7% con ecografía transabdominal32. Sin embargo, la vía transabdominal suele ser de elección por su naturaleza no invasiva.
El Índice de protrusión prostática (IPP) mide la distancia (en mm) entre el cuello vesical y la porción más alta del lóbulo medio, en plano sagital, vía transabdominal. Sería un buen predictor de obstrucción al tracto de salida vesical, resultado de la prueba miccional, desarrollo de retención aguda de orina, falla de tratamiento médico y necesidad de resolución quirúrgica33.
El aumento ecográfico de grosor de pared vesical se asocia con BOO confirmada con urodinamia, aunque no hay valores de corte establecidos. Además, permitiría identificar la presencia de complicaciones como litiasis y divertículos vesicales.
La guía EAU 2019 recomienda de forma débil su realización previa al inicio de tratamiento y en forma fuerte previo a la resolución quirúrgica. La guía AUA 2019 recomienda la realización de un estudio imagenológico (ecografía, TAC, RM, cistoscopía) previo a la resolución quirúrgica. La guía NICE 2015 no establece recomendación al respecto.
-
Cistoscopía: no se considera como un estudio de primera línea, pero en casos seleccionados permite obtener información relevante de la anatomía prostática (lóbulo medio, grado de obstrucción, distancia veru-cuello) y comorbilidades (estenosis uretral, cáncer vesical, divertículos y litiasis vesicales).
La guía EAU 2019 recomienda su uso previo al tratamiento quirúrgico si su realización generará un cambio en la conducta. La guía AUA 2019 no establece una clara recomendación. La guía NICE 2015 recomienda su realización en casos seleccionados (infección recurrente, piuria estéril, hematuria, dolor)
Tratamiento
Las alternativas para pacientes con LUTS/HPB son variadas e incluyen observación, tratamiento medicamentoso y tratamiento quirúrgico. La definición de a quién tratar y cuándo, es parte tanto del arte como de la ciencia urológica.
Se debe considerar qué pacientes probablemente progresen o desarrollen complicaciones y cuáles son las expectativas del paciente. La selección del tratamiento y en especial la recomendación de cirugía, es el resultado de una negociación médico-paciente. Algunos aceptan bien su condición y están dispuestos a tolerar síntomas molestos, antes que enfrentar cirugía, mientras que otros agradecen una cirugía como solución definitiva a sus molestias.
En pacientes en los cuales la evaluación clínica determina probable diagnóstico de LUTS secundarios a HPB, se procede de acuerdo a la severidad de los síntomas, según IPSS. En pacientes con síntomas leves se recomienda observación. Con síntomas moderados o molestias significativas, intentar modificaciones de la vida diaria e iniciar tratamiento médico. En aquellos pacientes que no obtienen alivio, se pueden hacer ajustes de dosis o dar fármacos adicionales.
Si las molestias continúan significativas, o es preferencia del paciente, se discutirá tratamiento quirúrgico, evaluando necesidad o no de estudios adicionales.
1) Observación:
La mayoría de los pacientes con LUTS leves a moderados, sin complicación y no muy molestos por sus síntomas o que no les ocasionan problemas en su calidad de vida, pueden ser manejados con observación vigilada. La distinción en categorías de IPSS establece severidad y permite detectar a los pacientes con riesgo de desarrollar complicaciones.
La observación evita el tratamiento en pacientes donde los síntomas permanecen estables o remiten en el tiempo. Aproximadamente 85% de los hombres en observación no progresan a un año de control, llegando a 65% a los 5 años20.
Es importante considerar el RPM en este manejo terapéutico, ya que su incremento puede ser índice inicial de una vejiga en descompensación, pero aún poco sintomática.
Observación incluye:
- Información al paciente sobre los objetivos del seguimiento
- Tranquilizar, destacando ausencia de cáncer prostático
- Control periódico con UFM y RPM, IPSS y APE.
- Cambios de estilo de vida:
- Reducir líquidos cuando sea conveniente (antes de dormir o ir a lugares públicos).
- Evitar o moderar cafeína o alcohol.
- Micción relajada, sin apuro, o doble vaciado vesical.
- Ordeñe uretral final para evitar goteo post miccional.
- Técnicas de distracción, que ayuden a controlar síntomas de almacenamiento.
- Reeducación vesical, tratando de aumentar los intervalos intermiccionales.
- Revisión de medicamentos que afecten la micción; adecuación de dosis u horario.
- Advertencia sobre riesgo de empeoramiento de síntomas con el uso de anticolinérgicos, simpáticomimeticos, antidepresivos tricíclicos, etc.
- Corregir constipación, evitar permanencia prolongada en cama y estimular actividad física. Evitar sobrepeso.
- Evitar frío, stress, nerviosismo.
- Proveer asistencia cuando existan limitaciones a la movilidad, movilidad manual restringida o del estado mental.
2) Tratamiento médico
2.1) Bloqueadores adrenérgicos Alfa 1
Drogas disponibles: Cinco drogas bloqueadoras de receptores adrenérgicos alfa 1 de efecto prolongado han sido aprobadas por la FDA para el tratamiento de la HPB. Estas son terazosina, doxazosina, tamsulosina, alfuzosina y solidosina (no disponible en Chile).
Mecanismo de acción: Actúan corrigiendo el componente dinámico de la obstrucción a la salida de la vejiga, relajando el músculo liso en el cuello vesical, cápsula prostática y uretra prostática.
Tres subtipos de receptores alfa 1 han sido caracterizados, estos son: 1 A, 1 B y 1 D. Terazosina, doxazosina y alfuzosina tienen un efecto antagonista sobre los tres subtipos de receptores alfa, mientras que tamsulosina ha demostrado selectividad sobre receptores alfa 1 A y 1 D. Silodosina es un antagonista selectivo específico del receptor alfa 1 A.
Los receptores alfa 1 A dan cuenta del 70% de los adreno-receptores en el tejido prostático, mientras que los receptores alfa 1 B se encuentran mayormente en el músculo liso vascular. Los receptores alfa 1 D representan menos del 30% de los adreno-receptores prostáticos y están ubicados en los elementos del estroma glandular. Receptores alfa 1 D también se encuentran en el músculo detrusor de la vejiga, cuello vesical y en la región sacra de la médula espinal.
Eficacia: Los BA1 parecieran tener una eficacia similar34, sin embargo pocos trabajos los han comparado directamente. Los resultados indican que estas drogas son más efectivas que el placebo y la eficacia entre ellos es prácticamente igual. En el grupo de hombres tratados, el promedio de síntomas (IPSS) disminuyó un 30 a 40% y los flujos urinarios máximos aumentaron un 20 – 25%35.
Los alfa bloqueadores reducen los síntomas del tracto urinario inferior de almacenamiento y vaciado. Además, se evidenció que el tamaño prostático no afecta la efectividad de los alfa bloqueadores en estudios con seguimiento menor a un año; sin embargo, la efectividad de estas drogas a largo plazo, parece ser mejor en próstatas pequeñas (40 ml). Estas drogas no disminuyen el riesgo de retención aguda de orina o de requerir cirugía prostática en el futuro y sus efectos en reducción de síntomas y flujo urinario se mantienen al menos durante los primeros 4 años36.
Tolerabilidad y seguridad: Los efectos adversos más comunes son la hipotensión ortostática y los mareos. La hipotensión puede favorecer el manejo de los pacientes añosos con hipertensión, sin embargo, su uso debe ser monitorizado. Tamsulosina, alfuzosina y silodosina poseen menos riesgo de causar hipotensión en comparación con la doxazosina y terazosina. Además, la tamsulosina podría tener menos efecto sobre la presión arterial que la alfuzosina. Todas estas diferencias sobre la presión arterial se explican por la selectividad de cada alfa bloqueador a algún receptor distinto.
Otro efecto adverso del uso de alfa bloqueadores es la congestión nasal y la astenia. La tamsulosina y la silodosina pueden, además, afectar la eyaculación. En un estudio, tamsulosina disminuyó el volumen del eyaculado en más del 90% de los pacientes; incluso un 35% no presentó eyaculación. Este fenómeno no ocurrió con alfuzosina 10 mg. La silodosina produce eyaculación retrógrada en aproximadamente el 28% de los casos.
Con el uso de los BA1 puede ocurrir un acontecimiento ocular adverso, el síndrome del iris laxo intra-operatorio (SILI), que se ha descrito desde hace algunos años en el contexto de la cirugía de cataratas37. Aunque el SILI se ha observado con todos los alfa bloqueadores, la mayoría de los casos se han relacionado con tamsulosina. No está claro si esto refleja un riesgo mayor con tamsulosina que con otros alfa bloqueadores o más bien secundario a su uso generalizado38. Por consiguiente, parece prudente no iniciar tratamiento alfa bloqueador si se planea cirugía de cataratas, mientras que el ya existente debe suspenderse, aunque no está claro cuánto tiempo antes de la operación.
Consideraciones prácticas: Los BA1 constituyen el tratamiento farmacológico de primera línea en los hombres con LUTS secundarios a HPB. Sólo se recomienda un ajuste posológico al iniciar el tratamiento con doxazosina y terazosina, no siendo necesario con alfuzosina y tamsulosina. Debido a su rápido inicio de acción, en los pacientes con una frecuencia fluctuante de los síntomas puede considerarse el uso de terapia intermitente.
Se recomienda usar en pacientes con LUTS moderados a severos.
2.2) Inhibidores de la 5-Alfa reductasa
Drogas disponibles: Existen dos inhibidores de la enzima 5 alfa reductasa (I5AR) aprobados para el tratamiento de la HPB; estos son finasteride y dutasteride.
Mecanismo de acción: Estas drogas actúan reduciendo el tamaño de la glándula prostática y por lo general se requiere un periodo inicial de 6 a 12 meses para lograr una reducción en el tamaño prostático que refleje una mejoría en los síntomas. La enzima 5 alfa reductasa tipo 2 cataliza la conversión de testosterona en dihidrotestosterona en la próstata, folículos pilosos y en otros tejidos andrógeno sensibles. La enzima 5 alfa reductasa tipo 1 está presente en el hígado, piel y en menor cantidad en la próstata39.
El finasteride sólo inhibe la enzima 5 alfa reductasa tipo 2, mientras que el dutasteride inhibe la 5 alfa reductasa tipo 1 y 2 con una potencia similar. Los I5AR actúan induciendo la apoptosis de las células epiteliales de la próstata40, lo que provoca una reducción del tamaño de la próstata en un 15-25% y una disminución en el nivel de APE aproximadamente un 50% después de 6-12 meses de tratamiento41. La reducción media del volumen prostático puede ser incluso más pronunciada con el tratamiento a largo plazo.
Eficacia: En comparación con placebo, los efectos clínicos se observan tras una duración mínima del tratamiento de 6 a 12 meses. Al cabo de entre 2 y 4 años de tratamiento, los I5AR reducen los LUTS (IPSS) en un 15-30%, disminuyen el volumen prostático en un 18-28% y aumentan el flujo máximo en 1,5-2,0 ml/s36 26. La reducción de los síntomas derivados del uso de finasteride y dutasteride es claramente mejor que el placebo en próstatas mayores de 40 ml42. Finasteride además pudiera tener algún rol en la disminución de la macro-hematuria secundaria a la HPB43.
Los I5AR reducen, además, el riesgo a largo plazo (> 1 año) de retención aguda de orina o necesidad de cirugía26 44 45. La prevención de la progresión de la enfermedad con los I5AR ya se detecta con un tamaño de la próstata considerablemente menor de 40 ml36 45.
Tolerabilidad y seguridad: Los efectos adversos más significativos de los I5AR consisten en disminución de la libido, disfunción eréctil y, con menos frecuencia, trastornos de la eyaculación, como eyaculación retrógrada, falta de eyaculación o disminución del volumen seminal41 26. La incidencia de estos efectos puede ir desde un 4 a un 13%. Sin embargo, en estudios a largo plazo los efectos adversos de índole sexual aumentaron solo durante el primer año de terapia.
En algunos estudios randomizados, los I5AR han disminuido significativamente el riesgo de desarrollar cáncer prostático. Sin embargo, ha habido preocupación por la posibilidad de que estos fármacos aumenten la incidencia de cánceres prostáticos agresivos, aunque muchos creen que estos hallazgos no son reales46.
Consideraciones prácticas: El tratamiento con I5AR sólo debe considerarse en pacientes con LUTS y próstatas aumentadas de tamaño. Dada su acción de inicio lento, sólo son adecuados para el tratamiento a largo plazo. Su efecto sobre la concentración sérica del APE debe tenerse en mente en el momento del tamizaje del cáncer prostático. Cabe destacar que los I5AR podrían disminuir la hemorragia durante la resección transuretral de la próstata, probablemente a causa de sus efectos sobre la vascularización prostática.
Se recomienda el uso de I5AR en pacientes con LUTS moderados a severos y con factores de riesgo de progresión de su enfermedad (volumen prostático > 40 ml y APE > 1.4-1.6 ng/ml).
2.3) Antagonistas de receptores muscarínicos
Drogas disponibles: Las drogas antimuscarínicas aprobadas en Europa para el tratamiento de LUTS/OAB son: oxibutinina, solifenacina, tolterodina, cloruro de trospio, propiverina, darifenacina y fesoterodina (no disponible en Chile).
Mecanismo de acción: Las drogas antimuscarínicas actúan bloqueando el neurotransmisor acetilcolina tanto en el sistema nervioso central como en el periférico. Este tipo de medicamentos disminuye los efectos de la acetilcolina en las neuronas de la vejiga mediante inhibición competitiva de sus receptores. Cinco clases de receptores colinérgicos han sido descritos en el músculo detrusor, la mayoría de ellos están representados por los subtipos M2 y M3. A pesar de que los receptores M2 predominan en la vejiga, son los M3 los mayormente responsables de la contracción vesical.
Eficacia: La eficacia de la tolterodina y, más recientemente, de la fesoterodina se ha evaluado como monoterapia en hombres con síntomas relacionados con llene vesical, pero sin obstrucción a la salida de la vejiga47 48. La duración máxima de los estudios fue de 25 semanas. En ensayos abiertos con tolterodina también se redujo significativamente la polaquiuria diurna, la nicturia, la urgeincontinencia y el IPSS con respecto a los valores basales después de 12-25 semanas. En un estudio abierto realizado en pacientes sin respuesta a alfa bloqueadores, todas las respuestas del cuestionario IPSS mejoraron durante el tratamiento con tolterodina con independencia de los síntomas de llene vesical o miccionales49. En ensayos aleatorios y controlados con placebo se demostró que la tolterodina puede reducir significativamente la urgeincontinencia y la frecuencia diurna o durante 24 horas en comparación con placebo. También se constató que el tenesmo vesical relacionado con la micción disminuye de forma significativa con tolterodina50.
Aunque la nicturia, el tenesmo vesical y el IPSS se redujeron en la mayoría de los casos, estos parámetros no alcanzaron significación estadística en la mayor parte de los ensayos. Sin embargo, cuando el resultado del tratamiento se estratificó en función de la concentración de PSA (volumen prostático), tolterodina redujo significativamente la frecuencia diurna, la frecuencia miccional durante 24 horas y los síntomas de ocupación vesical en el IPSS en los varones con una concentración de APE inferior a 1,3 ng/ml, lo que indica que los hombres con próstatas más pequeñas podrían beneficiarse en mayor grado de los medicamentos antimuscarínicos50.
Tolerabilidad y seguridad: Los antagonistas de los receptores muscarínicos son bien tolerados en general. Los eventos adversos más comunes son: sequedad de boca (16%), mareo (5%), estreñimiento (4%), infección de las vías respiratorias superiores (3%) y dificultad en la micción (2%). El aumento del residuo post miccional (RPM) en los pacientes sin obstrucción a la salida de la vejiga es mínimo y no significativamente diferente en comparación con placebo.
En los hombres con obstrucción a la salida de la vejiga no se recomiendan los medicamentos antimuscarínicos debido a la reducción teórica de la fuerza vesical que podría asociarse a retención urinaria. Un estudio controlado con placebo de 12 semanas en pacientes con obstrucción leve o moderada a la salida de la vejiga reveló que la tolterodina aumentó significativamente la cantidad de RPM (49 frente a 16 ml), pero no se asoció a un mayor número de episodios de retención urinaria aguda (RAO) (3% en ambos grupos del estudio)51. Los efectos urodinámicos de la tolterodina consistieron en volúmenes vesicales significativamente mayores hasta la primera contracción del detrusor, mayor capacidad vesical cistométrica máxima y disminución del índice de contractilidad vesical. El flujo urinario máximo se mantuvo inalterado en los grupos de tolterodina y placebo. Este ensayo aislado indicó que el tratamiento a corto plazo con medicamentos antimuscarínicos en los hombres con obstrucción a la salida de la vejiga es seguro.
Consideraciones prácticas: Aunque los estudios efectuados en varones de edad avanzada con LUTS y síntomas de vejiga hiperactiva se llevaron a cabo exclusivamente con tolterodina o fesoterodina, es probable que con otros medicamentos antimuscarínicos también aparezca una eficacia y efectos adversos similares. Siguen faltando estudios a largo plazo sobre la eficacia de los antagonistas de receptores muscarínicos en hombres con LUTS. La AUA, en sus guías de manejo de la HPB, recomienda el uso de anticolinérgicos con precaución en pacientes con RPM mayores de 250 – 300 ml52.
Las guías de la EAU recomiendan usar estas drogas principalmente en pacientes que tengan síntomas de almacenamiento y no usarlas en pacientes con RPM > 150 ml.
2.4) Inhibidores de la fosfodiesterasa 5
Drogas disponibles: Existen tres drogas inhibidoras de la enzima fosfodiesterasa 5 (PDE 5) aprobadas para el tratamiento de la disfunción eréctil; estas son: sildenafil, vardenafil y tadalafilo. Todas ellas han sido incluidas en estudios para tratamiento de LUTS en hombres, sin embargo, solo tadalafilo ha sido aprobado para el uso en pacientes con UOB secundaria a HPB. Esto se debe, en parte, a su vida media prolongada y la opción de uso diario en dosis de 5 mg.
Mecanismo de acción: Los inhibidores de la PDE 5 aumentan la concentración intracelular de GMP cíclico, prolongando su actividad, lo que lleva a la relajación del músculo detrusor, prostático y uretral53.
Eficacia: Estudios en pacientes con disfunción eréctil tratados con sildenafil mostraron que los inhibidores de la PDE 5 también eran capaces de mejorar considerablemente los LUTS y los valores del IPSS54 55. Otros trabajos posteriores randomizados con uso de placebo, concluyeron que todos los inhibidores de la PDE 5 producían una reducción de un 17–37% en el IPSS y una mejoría en el índice de calidad de vida de estos pacientes. El flujo máximo mostró un aumento dependiente de la dosis administrada, pero que no fue significativamente distinto al grupo placebo56, 57.
Con relación al uso de tadalafilo 5 mg, existe evidencia que demuestra que esta droga reduce el IPSS en un 22–37% incluso después de la primera semana de tratamiento y aumenta el flujo máximo en 2.4ml/s58. Un meta-análisis publicado en el año 2012 evidenció que el uso de terapia combinada (inhibidores de la PDE 5 con alfa bloqueadores) mejoraban significativamente el flujo máximo (+ 1.5 ml/s) e IPSS (-1.8), comparados con el uso aislado de alfa bloqueadores59.
Tolerabilidad y seguridad: El uso de tadalafilo puede causar cefalea en un 2–3%, dorsalgia, mareos y dispepsia. Está contraindicada en pacientes en tratamiento con nitratos puesto que podría potenciar su efecto hipotensor60.
Consideraciones prácticas: Hoy en día, sólo el uso de tadalafilo 5 mg al día ha sido oficialmente aprobado para de hombres con LUTS con o sin disfunción eréctil. El tipo de pacientes que más se beneficia de esta droga son hombres jóvenes, con bajo IMC y LUTS severos59. No existe evidencia actual que nos permita evaluar tolerabilidad y eficacia en tratamientos a largo plazo (>1 año). Tampoco contamos con suficiente evidencia en relación con el uso combinado de inhibidores de PDE 5 y otros medicamentos para el tratamiento de LUTS.
2.5) Agonistas beta 3
Mecanismo de acción: Los receptores beta 3 adrenérgicos, son los receptores beta predominantes en el músculo liso de la vejiga. Su estimulación induce la relajación del músculo detrusor.
Eficacia: Mirabegron 50 mg es el primer agonista beta 3 disponible para el uso clínico en pacientes con vejiga hiperactiva. Múltiples estudios randomizados a nivel mundial avalan su uso61 62. Si bien es cierto muchos de estos estudios han sido en población femenina, existe un metaanálisis con un tercio de los pacientes de sexo masculino, en donde se vio reflejado que esta droga mejoraba la frecuencia, urgencia, urgeincontinencia así como también el volumen vaciado con una mejoría significativa de la nicturia en comparación con el placebo y la tolterodina63. Otros estudios también han demostrado su efectividad en pacientes que ya estaban tomando alfa bloqueadores y que persistían con LUTS, sin verse afectado el vaciamiento vesical64.
Tolerabilidad y seguridad: En general, Mirabegron tiene mejor tolerabilidad y adherencia terapéutica que las drogas antimuscarínicas65. Dentro de sus efectos adversos más relevantes se encuentran la hipertensión, ITU, cefalea y nasofaringitis. Es por esto que el uso de esta droga está contraindicado en pacientes con mal manejo de su hipertensión la cual debe ser controlada periódicamente durante el tratamiento. La proporción de pacientes con sequedad bucal o constipación es considerablemente más baja con el uso de mirabegron que con el uso de tolterodina u otras drogas para el tratamiento de la vejiga hiperactiva61. El efecto de esta droga en el aumento del RPM es insignificante66.
Consideraciones prácticas: Todavía no existen estudios de eficacia y seguridad que avalen el uso de mirabegron en hombres de cualquier edad con LUTS. Estudios de terapia combinada con otras drogas clásicas para el manejo de LUTS también están pendientes. Sin embargo la interacción farmacocinética de esta droga con tamsulosina no cambia el perfil de seguridad en los pacientes que la utilizan67.
Recomendaciones: Las guías de la EAU 2019 recomiendan el uso de Mirabegron en aquellos pacientes con LUTS moderados a severos con predominio de síntomas de almacenamiento (recomendación débil).
2.6) Terapia combinada: bloqueadores Alfa-1 con inhibidores de 5-Alfa reductasa
Drogas disponibles: Consiste en la combinación de bloqueadores alfa 1 e inhibidores de la 5 AR. El efecto benéfico del alfa bloqueador se obtiene rápidamente (horas, días), mientras que el efecto benéfico del I5AR se manifiesta después de varios meses.
Mecanismo de acción: La combinación de ambas drogas busca potenciar el efecto benéfico de cada una de ellas para así mejorar la clínica y prevenir la progresión de la enfermedad.
Eficacia: Algunos estudios han investigado la eficacia de la terapia combinada por sobre la eficacia de la monoterapia con alfa bloqueadores, I5AR o placebo36 26 68 69. Los primeros reportes, con períodos de seguimiento entre 6–12 meses, demostraban que el uso de alfa bloqueadores aislado era superior a finasteride como monoterapia en reducción de LUTS, mientras que la terapia combinada no fue superior a la monoterapia con alfa bloqueadores.
Recientemente han sido publicados los resultados del estudio MTOPS a 4 años, así como los resultados de 2 y 4 años del estudio CombAT. Este último, incluyó pacientes añosos con próstatas de mayor volumen y concentraciones elevadas de APE, por lo tanto, con mayor riesgo de progresión de enfermedad.
En contraste con los primeros trabajos con sólo 6–12 meses de seguimiento, la evidencia de estudios a largo plazo ha demostrado que el tratamiento combinado es superior a monoterapia en cuanto a la reducción de síntomas y mejoría de flujo máximo, y superior al alfa bloqueo en la disminución del riesgo de retención aguda de orina o necesidad de cirugía.
El estudio CombAT demostró que la terapia combinada es superior a la monoterapia con relación a la mejoría de los síntomas y flujo máximo, desde el noveno mes, y superior al alfa bloqueo en relación al riesgo de la retención aguda de orina y la necesidad de cirugía futura a partir del octavo mes36.
El estudio MTOPS mostró que el riesgo de progresión de enfermedad a largo plazo, principalmente dada por aumento en el IPSS, se redujo en un 66% con el uso de terapia combinada (versus placebo). Adicionalmente, finasteride solo o en combinación, pero no doxazosina como monoterapia, redujo considerablemente el riesgo de retención aguda de orina y la necesidad de cirugía secundaria a HPB en el estudio a 4 años. En el estudio CombAT, el uso de terapia combinada redujo el riesgo relativo de retención aguda de orina en un 67.8%, necesidad de cirugía en un 70.6% y en un 41.3% la progresión de síntomas comparada con tamsulosina, luego de cuatro años de tratamiento36.
Tolerabilidad y seguridad: La frecuencia de efectos adversos con uso de terapia combinada es mayor que con el uso de monoterapia. Los efectos adversos producidos son similares a los mencionados con cada droga en particular.
Consideraciones prácticas: En comparación con la monoterapia con alfa bloqueadores o un inhibidor de la 5 AR, el tratamiento combinado ofrece una mayor mejoría de los LUTS, un aumento del flujo máximo y una mejor prevención de la progresión de la enfermedad. Sin embargo, el tratamiento combinado también se acompaña de más efectos adversos. A modo de recomendación, el tratamiento combinado debe utilizarse principalmente en hombres que manifiestan LUTS moderados o severos y con riesgo de progresión de enfermedad (mayor volumen prostático, mayor concentración de APE, edad avanzada). El tratamiento combinado sólo debe utilizarse cuando se piensa en un tratamiento a largo plazo (más de 12 meses). En los hombres con LUTS moderados se podría suspender el uso del alfa bloqueador después de 6 meses.
2.7) Terapia combinada: bloqueadores Alfa-1 con antagonistas de receptores muscarínicos
Drogas disponibles: Esta terapia combinada consiste en el uso de un alfa bloqueador en conjunto con un antimuscarínico. Sin embargo, no todas las combinaciones posibles han sido estudiadas en trabajos clínicos.
Mecanismo de acción: El tratamiento combinado con un alfa bloqueador y un antagonista de los receptores muscarínicos intenta antagonizar los receptores adrenérgicos alfa 1 y los receptores colinérgicos muscarínicos (M2 y M3) en las vías urinarias inferiores, de modo que se emplea la eficacia de ambos grupos terapéuticos para lograr efectos sinérgicos.
Eficacia: Se han publicado al menos nueve ensayos sobre la eficacia del tratamiento combinado con alfa bloqueadores y antimuscarínicos en hombres adultos con LUTS70. La duración máxima de los estudios fue de 25 semanas. La terapia combinada fue, en general, más eficaz en reducir la frecuencia miccional, la nicturia o el IPSS que los alfa bloqueadores o el placebo como monoterapia. Además, el tratamiento combinado redujo significativamente los episodios de urge-incontinencia, el tenesmo vesical y aumentó significativamente la calidad de vida71.
La mejoría sintomática global en el grupo de tratamiento combinado fue significativamente mayor que con placebo, sin importar la concentración sérica de APE, mientras que la tolterodina en monoterapia mejoró notoriamente los síntomas, predominantemente en aquellos pacientes en donde la concentración sérica de APE era inferior a 1,3ng/ml36. En tres estudios se investigó la eficacia del tratamiento combinado en pacientes con LUTS persistentes a pesar de tratamiento con alfa bloqueadores mediante la adición de un antimuscarínico47 71 72. En estos ensayos se demostró que los LUTS persistentes pueden reducirse significativamente mediante el uso adicional de un antagonista de los receptores muscarínicos (tolterodina), sobre todo cuando se ha confirmado hiperactividad del detrusor.
Tolerabilidad y seguridad: Reacciones adversas de ambas drogas han sido reportadas en tratamiento combinado. El principal efecto adverso reportado en todos los trabajos usando terapia combinada fue la xerostomía.
Algunos trabajos demostraron aumento en el RPM con el uso de terapia combinada sin ser clínicamente significativos. El riesgo de retención aguda de orina parece ser bajo47,50.
Consideraciones prácticas: La determinación del RPM se sugiere durante el tratamiento combinado para evaluar su aumento o la presencia de retención urinaria.
Se recomienda usar esta terapia combinada cuando los síntomas de almacenamiento no han sido controlados totalmente con el uso de alfa bloqueadores.
2.8) Fitoterapia y extractos de plantas
Los productos fitoterapéuticos son un grupo heterogéneo de extractos de plantas que se utilizan para intentar mejorar los LUTS secundarios a HPB. Dentro de estos compuestos podemos mencionar Cucurbita pepo (pepas de calabaza), Hypoxis rooperi (patata silvestre africana), Pygeum africanum (corteza del ciruelo africano), Secale cereale (polen de centeno), Serenoa repens (Saw Palmetto), Urtica dioica (raíces de la ortiga mayor).
El uso de la fitoterapia sigue siendo controversial debido a las diferentes concentraciones de principios activos presentes en distintas marcas del mismo producto. Por consiguiente, no parece que estén justificados metaanálisis de extractos de la misma planta y los resultados de estos análisis han de interpretarse con precaución52.
El comité de guías clínicas europeas no emite recomendaciones específicas sobre la fitoterapia como tratamiento de LUTS en hombres debido a la heterogeneidad de los productos y los problemas metodológicos relacionados con los estudios publicados70.
3) Tratamiento quirúrgico
Ya desde principios del siglo XX se describieron técnicas quirúrgicas para el manejo de la hiperplasia prostática, algunas de las cuales persisten hasta ahora como excelentes opciones de tratamiento.
Desde un principio el enfrentamiento fue mediante cirugía abierta (adenomectomia transvesical y transcapsular (técnica de Millin)73. Ambas tienen en común la enucleación completa del tejido hiperplásico, y sus resultados a largo plazo son de los mejores, con tasas de retratamiento por recidiva obstructiva menores al 1%.
Fue a contar de los años 30 que se van agregando técnicas endoscópicas gracias al desarrollo de la cistoscopía. Estas técnicas reemplazan la enucleación mediante cirugía abierta por la resección y coagulación del tejido. En principio utilizando energía eléctrica (resección transuretral de próstata monopolar y bipolar), a la cual se le agrega posteriormente la utilización de energía láser para vaporizar tejido. Se consigue de esta manera recuperación más rápida, menor sangrado y menor tiempo de uso de sonda uretral. Sin embargo, los resultados a largo plazo, principalmente en pacientes con próstatas grandes (mayores de 70 – 80cc) no eran los mejores dada la alta tasa de retratamiento por recidiva obstructiva.
En 1995 en Nueva Zelandia se comienzan a desarrollar técnicas de enucleación por vía endoscópica, las que permiten obtener los resultados a largo plazo de la cirugía abierta, pero con las ventajas de la vía endoscópica (ausencia de herida de piel, menos tiempo de uso de sonda y alta precoz).
A continuación, se desarrollan las técnicas quirúrgicas más utilizadas, con una descripción general de sus resultados e indicaciones.
3.1) Adenomectomía abierta
Corresponde a la técnica más antigua descrita para el manejo de este cuadro, y que sigue plenamente vigente al día de hoy. Puede practicarse vía transvesical (descrita por Freyer) o vía retropúbica transcapsular (Millin). Tiene dentro de sus ventajas la simplicidad en su implementación (requiere instrumental básico para cirugía abierta) lo que le da su disponibilidad prácticamente universal73 74.
Indicaciones: Principalmente pacientes con volúmenes prostáticos mayores de 70 – 80 cc. En volúmenes menores, la Resección Trans Uretral (RTU) de próstata tiene ventajas en cuanto a la morbilidad perioperatoria y al requerimiento de sonda uretral. También es posible resolver con estas técnicas la presencia de litiasis vesical, concomitante con la hiperplasia obstructiva.
Resultados: Sus resultados son de los mejores y suelen mantenerse a lo largo del tiempo (reducción de síntomas en 63 a 86%, aumento del flujo máximo en 375%, reducción de residuo postmiccional en 86 a 98%). Dentro de sus desventajas están la larga estadía postoperatoria (promedio 5,4 días), requerimiento prolongado de sonda uretral (4,1 a 4,4 días) y moderado riesgo de sangrado, con una tasa de transfusión de entre 6,8 y 8,2% de los pacientes operados75 76.
3.2) RTU prostática monopolar y bipolar
Fue descrita en 1932 por Martin77. Ampliamente enseñada en los programas de formación de urología, es prácticamente universal. Requiere cierto instrumental específico para esta técnica (óptica, resectoscopio, asa de resección, fuente de luz, idealmente cámara y monitor). Se acepta que los volúmenes tratables con esta técnica son entre 30 y 80 cc, pero el límite superior no está definido por estudios adecuados, y más bien corresponde a una opinión de expertos. A mayor volumen prostático, mayor es el riesgo de sangrado (tasa de transfusión de 2,9%) y de síndrome post RTU (dado por hemodilución e hiponatremia, secundarias a la absorción de agua libre al intravascular; afecta al 1% de los casos). Para disminuir este riesgo de complicaciones, y permitir abordar mayores volúmenes, se ha desarrollado la RTU con corriente bipolar.
Indicaciones: Permite tratar próstatas con volúmenes entre 30 y 70 a 80 cc (dependiendo de la habilidad del cirujano). Volúmenes mayores eventualmente podrían ser tratados con la misma técnica, pero los resultados a largo plazo podrían no ser los mejores.
Resultados: Ambas técnicas tienen una eficacia demostrada mediante metaanálisis, reduciendo en un 70% la sintomatología medida mediante escala de síntomas IPSS, y aumentando el flujo máximo en 125%, sin existir diferencias significativas entre ambas70.
A largo plazo el riesgo de complicaciones incluye incontinencia urinaria (2,2%), retención urinaria, estenosis de cuello e infección urinaria (4,7%), estenosis uretral (3,8%), eyaculación retrógrada (65%) y disfunción eréctil (6,5%)78 79.
3.3) Incisión prostática transuretral (Transurethral incision of the prostate -TUIP)
Descrita por Orandi en 1969, se considera la terapia de elección en caso de pacientes con LUTS refractarios a manejo médico, y con volumen prostático menor de 30 cc y sin lóbulo medio. Simple de realizar, consiste básicamente en practicar dos incisiones que van desde el cuello vesical hasta el veru montanum, llegando a plano capsular, sin resecar tejido alguno.
3.4) Cirugía prostática mediante láser
LASER (Ligth Amplification by Stimulated Emission of Radiation) es un tipo de energía que es absorbida por el tejido provocando aumento de temperatura, lo que provoca desde coagulación hasta evaporación del tejido. Esta absorción es mediada por un cromóforo (estructura química capaz de absorber una determinada frecuencia de luz, los más conocidos son la hemoglobina y el agua). El sistema más empleado en la Urología corresponde al láser de Neodimio-Itrio-Aluminio-Granate (Nd-YAG). Este es la base a la cual se le adicionan distintos cristales que permiten generar las distintas energías (cristal de Holmium, Thulium, Potasio titanyl fosfato (KTP), litio triborato (LBO).
3.4.1) Vaporización con láser verde:
Corresponde al láser de neodimio YAG al que se adiciona un cristal de KTP, o uno de LBO, lo que transforma la longitud de onda del Nd-YAG desde 1064 a 532 nm. Esto permite que sea absorbido por la hemoglobina, actuando como un cromóforo intracelular, y no por el agua. A la fecha está disponibles el láser verde de 180 W XPS (LBO).
La técnica habitual emplea fibras de disparo lateral, que permite aplicar la energía directamente sobre el tejido prostático a tratar generando vaporización. Esta técnica no reseca tejido, por lo que no hay muestra para anatomía patológica.
La evidencia mayor hasta la fecha compara RTUp con láser KTP 80 W, no encontrándose diferencias significativas en flujo máximo y mejoría de síntomas. Tiene una tasa de retratamiento de 7.7% a 5 años debido a recidiva obstructiva por adenoma80. Esta técnica permite tratar cualquier volumen prostático (en teoría), pero en volúmenes mayores de 80cc los resultados disminuyen a largo plazo81. Existe evidencia de menor tiempo de uso de sonda y de estadía hospitalaria en ablación con láser vs RTUp. También hay evidencia de la seguridad de su uso en pacientes en tratamiento anticoagulante82 83.
3.4.2) Enucleación prostática mediante láser:
Así como la adenomectomía abierta, es posible enuclear el tejido prostático de la zona central, pero mediante procedimiento endoscópico. Técnica descrita en 1983 por Hiraoka84. Fue hasta 1993 que se popularizó la enucleación endoscópica con la publicación de Fraundhorfer y Gilling, en que muestran sus resultados mediante enucleación endoscópica con uso de láser de holmium85. Tras esto, el uso de otras plataformas de energía para enucleación endoscópica de próstata se fue ampliando, hasta encontrar en la actualidad publicaciones de enucleación endoscópica de próstata con láseres de Holmio, Thulio y Verde, y con uso de energía bipolar. Todas tienen en común la factibilidad de abordar próstatas de cualquier tamaño (incluso mayores de 80 cc), con resultados a largo plazo similares a la cirugía abierta, pero con menor morbilidad perioperatoria.
Holmium: Con una longitud de onda de 2140 nm, el láser de Holmium es un láser de entrega pulsada, cuyo cromóforo es el agua. Tiene una profundidad de penetración de 0.5 mm. Descrita por Gilling en 199386, la enucleación prostática con láser de Holmium (HoLEP) ha acumulado evidencia que demuestra su seguridad para el tratamiento quirúrgico de la hiperplasia de próstata, independiente del tamaño de esta. Los elementos en contra de esta técnica son el mayor tiempo quirúrgico requerido, la curva de aprendizaje (aproximadamente 30 casos) y la necesidad de equipamiento adecuado (láser, morcelador). Su principal grupo de aplicación corresponde a las próstatas de gran tamaño (mayores de 70-80 cc), en las cuales ninguna otra técnica endoscópica ha superado a la cirugía abierta. La evidencia habla de resultados equivalentes a los obtenidos con cirugía abierta, pero con menos requerimiento de sonda uretral (22.5 horas vs 150 horas para cirugía abierta) y menor estadía hospitalaria (27.5 horas vs 196 horas para cirugía abierta). También la necesidad de transfusión se reduce en 9.8% en cirugía abierta vs 0.84% en HoLEP81.
Thulium: El láser de tulio (Tm: YAG) se introdujo en la cirugía urológica de tejidos blandos en 2005. Emite energía láser en forma de onda continua a una longitud de onda de 2013 nm. La enucleación endoscópica de próstata mediante láser de Thulium (ThuLEP) se introdujo en 2010 por Herrmann et al87. Con similares resultados, la sensación intraoperatoria es que el láser de Thulium vaporiza más tejido al contacto, por lo que algunos cirujanos lo prefieren para hacer una técnica mixta de “vapoenucleación”.
Verde o Greenlight: Tradicionalmente utilizado para fotovaporización prostática, el láser verde se ha utilizado para enucleación prostática desde al año 2010, cuando Fernando Gómez Sancha publica sus resultados de una técnica mixta de vapoenucleación con láser verde, siguiendo luego con enucleación total y posteriormente con el desarrollo de enucleación prostática con técnica en bloque (en una pieza, sin incisiones intraprostáticas como las técnicas previamente desarrolladas)88. Con resultados similares a la enucleación con Holmium, está dentro de las opciones cada vez más difundidas para realizar enucleación endoscópica89.
Enucleación prostática con energía bipolar: Con el desarrollo de enucleación con diferentes plataformas láser, el interés por buscar otras fuentes de energía llevó al desarrollo de enucleación con asa bipolar, publicada inicialmente en 2006. Comparada con la enucleación con láser de holmio, mostró resultados similares, con beneficios económicos evidentes al prescindir de equipamiento láser90.
3.5) Técnicas emergentes
En la búsqueda de nuevas técnicas y equipamientos para manejar la hiperplasia prostática benigna, el foco se ha puesto en facilitar el aprendizaje (dado que las técnicas de enucleación endoscópica requieren un aprendizaje estimado de 30 casos), en ofrecer alternativas ambulatorias y de rápido reintegro laboral, y en posibilidad de preservación de eyaculación (aunque las técnicas endoscópicas permiten ciertas variaciones técnicas para preservar eyaculación, sus resultados suelen ser pobres).
Aquablation: Técnica desarrollada a partir de la utilización de una plataforma robótica (Procept Biorobotics), la ablación prostática mediante jet de agua es una técnica endoscópica, controlada mediante ultrasonido transrectal, en la cual una consola controla la emisión de jets de agua a altísima velocidad, que van destruyendo el tejido hiperplásico previamente diagramado en la consola. Tiene 2 ventajas principales: reproducibilidad, dado que es un procedimiento robotizado, está altamente estandarizado, con mínimo margen de error, controlado paso a paso por la consola encargada de emitir los jets de agua. Y es muy rápida, con tiempos promedios de 15 minutos desde la planificación ecográfica hasta la instalación de la sonda uretral. Aún faltan estudios para establecer con seguridad sus beneficios, al menos se puede concluir que es similar a la resección transuretral91 92.
Rezum: Aprobada por la FDA el 2015, la inyección intraprostática de vapor de agua (REZUM) consiste en la aplicación de pequeñas dosis controladas de vapor de agua a alta temperatura en puntos precisos del tejido prostático adenomatoso, que provoca en los siguientes días necrosis tisular con atrofia y disminución del volumen. Procedimiento ambulatorio, bajo sedación, tiene como principal ventaja la preservación de eyaculación en hasta un 95% de los pacientes tratados. El inconveniente es que requiere sonda uretral por al menos 3 días, dado el riesgo de retención urinaria post procedimiento. Apta para próstatas de hasta 80 – 90 cc, tiene una tasa de retratamiento a 5 años de 4%.
Urolift: Consiste en la aplicación de ganchos de nitinol por vía endoscópica, los que comprimen el tejido prostático desde la luz hacia la cápsula, otorgando un alivio inmediato de los síntomas obstructivos. Procedimiento ambulatorio, bajo sedación, usualmente sin requerimiento de sonda uretral, permite un inmediato retorno a actividades habituales. En todos los pacientes se mantiene eyaculación anterógrada. La mejoría de los parámetros obstructivos (síntomas y flujo máximo) alcanza al 50% de los valores pretratamiento.
Los mejores resultados quirúrgicos a largo plazo son la cirugía abierta y la enucleación prostática mediante láser (HoLEP). Pareciera que el ENUCLEAR el tejido hiperplásico es lo que otorga ventaja por sobre el resto de las alternativas quirúrgicas. Esto está demostrado en volúmenes prostáticos mayores de 80 cc. La tabla 1 muestra un resumen de artículos publicados que comparan técnicas aplicables en este grupo de pacientes81.
| Técnica | Disminución APE (%) | Mejoría síntomas IPSS (puntos) |
Mejoría
Qmáx (ml/seg) |
Horas de sonda uretral | Horas de hospitalización |
| Transvesical | 77,7 | -17,7 | 12,8 | 150 | 196 |
| HoLEP | 90 | -16 | 18,7 | 22,5 | 27,5 |
| Vaporización laser | 51,5 | -13,6 | 9,2 | 23,5 | 29,5 |
Tabla 1: Resultados a 1 año con 3 técnicas distintas, para próstatas mayores de 80 cc.
| Técnica | Tamaño prostático recomendado (cc) | Anestesia requerida | Horas de sonda uretral | Horas de hospitalización |
| Transvesical | Mayor de 80 | Espinal o general | 150 | 196 |
| Resección endoscópica | Menor de 80 | Espinal | 48 a 72 | 72 a 96 |
| Enucleación endoscópica | Independiente | Espinal o general | 22,5 | 27,5 |
| Vaporización laser | Menor de 80 | Espinal o general | 23,5 | 29,5 |
| Aquablation | Independiente | Espinal o general | 24 a 48 horas | 48 |
| Rezum | Menor de 80 (en estudio) | Local + sedación | 3 a 5 días | Ambulatorio |
| Urolift | Menor de 80 | Local + sedación | Sin sonda | Ambulatorio |
Tabla 2: Tamaño prostático recomendado, anestesia, uso de sonda y modalidad de ingreso de paciente para distintas técnicas quirúrgicas en hiperplasia prostática benigna
CONCLUSIÓN
Sin duda la hiperplasia prostática benigna es una de las patologías a las que con mayor frecuencia se ve enfrentado el urólogo. Los conocimientos de su fisiopatología, clínica y manejo tanto médico como quirúrgico, son pilar fundamental de nuestra práctica diaria.
Disponemos de nuevas alternativas terapéuticas farmacológicas y quirúrgicas El conocimiento de la distribución de los receptores adrenérgicos y el descubrimiento de los bloqueadores apropiados, aunado a la inhibición de la utilización intracelular de la testosterona, significó un enorme avance en el manejo médico de la HPB. En la actualidad permite que pacientes que antes habrían debido someterse a una operación, convivan largamente con síntomas perfectamente tolerables, difiriendo e incluso evitando definitivamente una cirugía. Por otra parte, la creciente disponibilidad de láser, así como los buenos resultados y seguridad que ofrece su uso, lo posicionan en un lugar relevante dentro de las técnicas que perdurarán en el tiempo, así como lo hicieron la cirugía abierta y la RTUP.
Pese a los avances, técnicas de larga utilización como la cirugía abierta y la RTUP, han permitido durante décadas y hasta el presente, resolver prácticamente la totalidad de los casos. Seguirán siendo seguramente las más aplicadas, mientras que técnicas con uso de láser y nuevas tecnologías están cada vez más incorporadas a la práctica habitual.
Bibliografía
1. Abrams P. New words for old: Lower urinary tract symptoms for “prostatism.” BMJ. 1994. doi:10.1136/bmj.308.6934.929
2. Ameda K, Sullivan MP, Bae RJ, Yalla S V. Urodynamic characterization of nonobstructive voiding dysfunction in symptomatic elderly men. J Urol. 1999. doi:10.1097/00005392-199907000-00035
3. Peters TJ, Donovan JL, Kay HE, et al. The international continence society “benign prostatic hyperplasia” study: The bothersomeness of urinary symptoms. J Urol. 1997. doi:10.1016/S0022-5347(01)65075-4
4. Robertson C, Link CL, Onel E, et al. The impact of lower urinary tract symptoms and comorbidities on quality of life: The BACH and UREPIK studies. BJU Int. 2007. doi:10.1111/j.1464-410X.2007.06609.x
5. Gacci M, Corona G, Sebastianelli A, et al. Male Lower Urinary Tract Symptoms and Cardiovascular Events: A Systematic Review and Meta-analysis. Eur Urol. 2016. doi:10.1016/j.eururo.2016.07.007
6. Gacci M, Corona G, Vignozzi L, et al. Metabolic syndrome and benign prostatic enlargement: A systematic review and meta-analysis. BJU Int. 2015. doi:10.1111/bju.12728
7. Guess HA, Arrighi HM, Metter EJ, Fozard JL. Cumulative prevalence of prostatism matches the autopsy prevalence of benign prostatic hyperplasia. Prostate. 1990. doi:10.1002/pros.2990170308
8. La Vecchia C, Levi F, Lucchini F. Mortality from benign prostatic hyperplasia: Worldwide trends 1950-92. J Epidemiol Community Health. 1995. doi:10.1136/jech.49.4.379
9. Sanda MG, Doehring CB, Binkowitz B, et al. Clinical and biological characteristics of familial benign prostatic hyperplasia. J Urol. 1997. doi:10.1016/S0022-5347(01)65069-9
10. Timms BG, Hofkamp LE. Prostate development and growth in benign prostatic hyperplasia. Differentiation. 2011. doi:10.1016/j.diff.2011.08.002
11. Grayhack JT, McVary KT KJ. No Title. In: Edicion 4ta, ed. Benign Prostatic Hyperplasia. In: Adult and Pediatric Urology,. ; 2002:1401.
12. Gooren L. Androgen deficiency in the aging male: Benefits and risks of androgen supplementation. In: Journal of Steroid Biochemistry and Molecular Biology. ; 2003. doi:10.1016/S0960-0760(03)00206-1
13. Bélanger A, Candas B, Dupont A, et al. Changes in serum concentrations of conjugated and unconjugated steroids in 40- to 80-year-old men. J Clin Endocrinol Metab. 1994. doi:10.1210/jcem.79.4.7962278
14. Coffey DS, Walsh PC. Clinical and experimental studies of benign prostatic hyperplasia. Urol Clin North Am. 1990.
15. Russo GM and GI. Lower Urinary Tract Symptoms and Benign Prostatic Hyperplasia From Research to Bedside.; 2018.
16. Nickel JC, Roehrborn CG, O’Leary MP, Bostwick DG, Somerville MC, Rittmaster RS. The Relationship between Prostate Inflammation and Lower Urinary Tract Symptoms: Examination of Baseline Data from the REDUCE Trial. Eur Urol. 2008. doi:10.1016/j.eururo.2007.11.026
17. De Marzo AM, Platz EA, Sutcliffe S, et al. Inflammation in prostate carcinogenesis. Nat Rev Cancer. 2007. doi:10.1038/nrc2090
18. Giovannucci E, Rimm EB, Chute CG, et al. Obesity and benign prostatic hyperplasia. Am J Epidemiol. 1994. doi:10.1093/oxfordjournals.aje.a117206
19. Hammarsten J, Högstedt B. Clinical, anthropometric, metabolic and insulin profile of men with fast annual growth rates of benign prostatic hyperplasia. Blood Press. 1999. doi:10.1080/080370599438365
20. Netto NR, Lopes De Lima M, Netto MR, Levi D’Ancona CA. Evaluation of patients with bladder outlet obstruction and mild international prostate symptom score followed up by watchful waiting. Urology. 1999. doi:10.1016/S0090-4295(98)00475-0
21. Anderson JB, Roehrborn CG, Schalken JA, Emberton M. The progression of benign prostatic hyperplasia: Examining the evidence and determining the risk. Eur Urol. 2001. doi:10.1159/000052475
22. Bosch JLHR, Bohnen AM, Groeneveld FPMJ. Validity of digital rectal examination and serum prostate specific antigen in the estimation of prostate volume in community-based men aged 50 to 78 years: The krimpen study. Eur Urol. 2004. doi:10.1016/j.eururo.2004.07.019
23. Roehrborn CG. Definition of at-risk patients: Baseline variables. BJU Int. 2006. doi:10.1111/j.1464-410X.2006.06098.x
24. Roehrborn CG, Boyle P, Bergner D, et al. Serum prostate-specific antigen and prostate volume predict long-term changes in symptoms and flow rate: Results of a four-year, randomized trial comparing finasteride versus placebo. Urology. 1999. doi:10.1016/S0090-4295(99)00232-0
25. Djavan B, Fong YK, Harik M, et al. Longitudinal study of men with mild symptoms of bladder outlet obstruction treated with watchful waiting for four years. Urology. 2004. doi:10.1016/j.urology.2004.08.049
26. McConnell JD, Roehrborn CG, Bautista OM, et al. The Long-Term Effect of Doxazosin, Finasteride, and Combination Therapy on the Clinical Progression of Benign Prostatic Hyperplasia. N Engl J Med. 2003. doi:10.1056/NEJMoa030656
27. Neal DE, McLoughlin J. Symptoms versus flow rates versus urodynamics in the selection of patients for prostatectomy [4]. Br J Urol. 1991.
28. Madersbacher S, Alivizatos G, Nordling J, Sanz CR, Emberton M, De La Rosette JJMCH. EAU 2004 guidelines on assessment, therapy and follow-up of men with lower urinary tract symptoms suggestive of benign prostatic obstruction (BPH guidelines). Eur Urol. 2004. doi:10.1016/j.eururo.2004.07.016
29. Hecht SL, Hedges JC. Diagnostic Work-Up of Lower Urinary Tract Symptoms. Urol Clin North Am. 2016. doi:10.1016/j.ucl.2016.04.002
30. Wasson JH, Reda DJ, Bruskewitz RC, Elinson J, Keller AM, Henderson WG. A comparison of transurethral surgery with watchful waiting for moderate symptoms of benign prostatic hyperplasia. N Engl J Med. 1995. doi:10.1056/NEJM199501123320202
31. Koch WFRM, El Din KE, De Wildt MJAM, Debruyne FMJ, De La Rosette JJMCH. The outcome of renal ultrasound in the assessment of 556 consecutive patients with benign prostatic hyperplasia. J Urol. 1996. doi:10.1016/S0022-5347(01)66589-3
32. Stravodimos KG, Petrolekas A, Kapetanakis T, et al. TRUS versus transabdominal ultrasound as a predictor of enucleated adenoma weight in patients with BPH: A tool for standard preoperative work-up? Int Urol Nephrol. 2009. doi:10.1007/s11255-009-9554-9
33. Rieken M, Presicce F, Autorino R, Denunzio C. Clinical significance of intravesical prostatic protrusion in the management of benign prostatic enlargement: A systematic review and critical analysis of current evidence. Minerva Urol e Nefrol. 2017. doi:10.23736/S0393-2249.17.02828-4
34. Djavan B, Chapple C, Milani S, Marberger M. State of the art on the efficacy and tolerability of alpha 1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Urology. 2004. doi:10.1016/j.urology.2004.07.031
35. Michel MC, Mehlburger L, Bressel HU, Goepel M. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms. Prostate Cancer Prostatic Dis. 1998. doi:10.1038/sj.pcan.4500267
36. Roehrborn CG, Siami P, Barkin J, et al. The Effects of Combination Therapy with Dutasteride and Tamsulosin on Clinical Outcomes in Men with Symptomatic Benign Prostatic Hyperplasia: 4-Year Results from the CombAT Study. Eur Urol. 2010. doi:10.1016/j.eururo.2009.09.035
37. Chang DF, Campbell JR. Intraoperative floppy iris syndrome associated with tamsulosin. J Cataract Refract Surg. 2005. doi:10.1016/j.jcrs.2005.02.027
38. Chatziralli IP, Sergentanis TN. Risk factors for intraoperative floppy Iris syndrome: A meta-analysis. Ophthalmology. 2011. doi:10.1016/j.ophtha.2010.08.039
39. Andriole G, Bruchovsky N, Chung LWK, et al. Dihydrotestosterone and the prostate: The scientific rationale for 5α-reductase inhibitors in the treatment of benign prostatic hyperplasia. J Urol. 2004. doi:10.1097/01.ju.0000139539.94828.29
40. Rittmaster RS, Norman RW, Thomas LN, Rowden G. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab. 1996. doi:10.1210/jcem.81.2.8636309
41. Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5α-reductase inhibitors for the enlarged prostate. Clin Ther. 2007. doi:10.1016/j.clinthera.2007.01.018
42. Nickel JC, Gilling P, Tammela TL, Morrill B, Wilson TH, Rittmaster RS. Comparison of dutasteride and finasteride for treating benign prostatic hyperplasia: The Enlarged Prostate International Comparator Study (EPICS). BJU Int. 2011. doi:10.1111/j.1464-410X.2011.10195.x
43. Donohue JF, Sharma H, Abraham R, Natalwala S, Thomas DR, Foster MC. Transurethral prostate resection and bleeding: A randomized, placebo controlled trial of the role of finasteride for decreasing operative blood loss. J Urol. 2002. doi:10.1016/S0022-5347(05)64287-5
44. McConnell JD, Bruskewitz R, Walsh P, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med. 1998. doi:10.1056/NEJM199802263380901
45. Tacklind J, Fink HA, Macdonald R, Rutks I, Wilt TJ. Finasteride for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2010. doi:10.1002/14651858.CD006015.pub3
46. Thompson IM, Goodman PJ, Tangen CM, et al. The influence of finasteride on the development of prostate cancer. N Engl J Med. 2003. doi:10.1056/NEJMoa030660
47. Athanasopoulos A, Chapple C, Fowler C, et al. The role of antimuscarinics in the management of men with symptoms of overactive bladder associated with concomitant bladder outlet obstruction: An update. Eur Urol. 2011. doi:10.1016/j.eururo.2011.03.054
48. Dmochowski R, Abrams P, Marschall-Kehrel D, Wang JT, Guan Z. Efficacy and Tolerability of Tolterodine Extended Release in Male and Female Patients with Overactive Bladder. Eur Urol. 2007. doi:10.1016/j.eururo.2006.10.005
49. Chapple CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: Focus on the bladder. Eur Urol. 2006. doi:10.1016/j.eururo.2006.02.018
50. Kaplan SA, Roehrborn CG, Abrams P, Chapple CR, Bavendam T, Guan Z. Antimuscarinics for treatment of storage lower urinary tract symptoms in men: A systematic review. Int J Clin Pract. 2011. doi:10.1111/j.1742-1241.2010.02611.x
51. Höfner K, Burkart M, Jacob G, Jonas U. Safety and efficacy of tolterodine extended release in men with overactive bladder symptoms and presumed non-obstructive benign prostatic hyperplasia. World J Urol. 2007. doi:10.1007/s00345-007-0212-5
52. McVary KT, Roehrborn CG, Avins AL, et al. Update on AUA guideline on the management of benign prostatic hyperplasia. J Urol. 2011. doi:10.1016/j.juro.2011.01.074
53. Kedia GT, Ückert S, Jonas U, Kuczyk MA, Burchardt M. The nitric oxide pathway in the human prostate: Clinical implications in men with lower urinary tract symptoms. World J Urol. 2008. doi:10.1007/s00345-008-0303-y
54. Sairam K, Kulinskaya E, McNicholas TA, Boustead GB, Hanbury DC. Sildenafil influences lower urinary tract symptoms. BJU Int. 2002. doi:10.1046/j.1464-410X.2002.03040.x
55. Mulhall JP, Guhring P, Parker M, Hopps C. Assessment of the impact of sildenafil citrate on lower urinary tract symptoms in men with erectile dysfunction. J Sex Med. 2006. doi:10.1111/j.1743-6109.2006.00259.x
56. Roehrborn CG, McVary KT, Elion-Mboussa A, Viktrup L. Tadalafil Administered Once Daily for Lower Urinary Tract Symptoms Secondary to Benign Prostatic Hyperplasia: A Dose Finding Study. J Urol. 2008. doi:10.1016/j.juro.2008.06.079
57. Porst H, McVary KT, Montorsi F, et al. Effects of Once-Daily Tadalafil on Erectile Function in Men with Erectile Dysfunction and Signs and Symptoms of Benign Prostatic Hyperplasia. Eur Urol. 2009. doi:10.1016/j.eururo.2009.04.033
58. Oelke M, Giuliano F, Mirone V, Xu L, Cox D, Viktrup L. Monotherapy with tadalafil or tamsulosin similarly improved lower urinary tract symptoms suggestive of benign prostatic hyperplasia in an international, randomised, parallel, placebo-controlled clinical trial. Eur Urol. 2012. doi:10.1016/j.eururo.2012.01.013
59. Gacci M, Corona G, Salvi M, et al. A systematic review and meta-analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with α-blockers for lower urinary tract symptoms due to benign prostatic hyperplasia. Eur Urol. 2012. doi:10.1016/j.eururo.2012.02.033
60. Wright PJ. Comparison of phosphodiesterase type 5 (PDE5) inhibitors. Int J Clin Pract. 2006. doi:10.1111/j.1742-1241.2006.01049.x
61. Chapple CR, Kaplan SA, Mitcheson D, et al. Randomized double-blind, active-controlled phase 3 study to assess 12-month safety and efficacy of mirabegron, a β3-adrenoceptor agonist, in overactive bladder. Eur Urol. 2013. doi:10.1016/j.eururo.2012.10.048
62. Yamaguchi O, Marui E, Igawa Y, Takeda M, Nishizawa O, Ikeda Y OS. Efficacy and Safety of the Selective β3 -Adrenoceptor Agonist Mirabegron in Japanese Patients with Overactive Bladder: A Randomized, Double-Blind, Placebo-Controlled, Dose-Finding Study. Low Urin Tract Symptoms. 2015.
63. Sebastianelli A, Russo GI, Kaplan SA, et al. Systematic review and meta-analysis on the efficacy and tolerability of mirabegron for the treatment of storage lower urinary tract symptoms/overactive bladder: Comparison with placebo and tolterodine. Int J Urol. 2018. doi:10.1111/iju.13498
64. Matsuo T, Miyata Y, Kakoki K, et al. The efficacy of mirabegron additional therapy for lower urinary tract symptoms after treatment with α1-adrenergic receptor blocker monotherapy: Prospective analysis of elderly men. BMC Urol. 2016. doi:10.1186/s12894-016-0165-3
65. Chapple CR, Nazir J, Hakimi Z, et al. Persistence and Adherence with Mirabegron versus Antimuscarinic Agents in Patients with Overactive Bladder: A Retrospective Observational Study in UK Clinical Practice. Eur Urol. 2017. doi:10.1016/j.eururo.2017.01.037
66. Nitti VW, Rosenberg S, Mitcheson DH, He W, Fakhoury A, Martin NE. Urodynamics and safety of the β3-adrenoceptor agonist mirabegron in males with lower urinary tract symptoms and bladder outlet obstruction. J Urol. 2013. doi:10.1016/j.juro.2013.05.062
67. Van Gelderen M, Tretter R, Meijer J, et al. Absence of clinically relevant cardiovascular interaction upon add-on of mirabegron or tamsulosin to an established tamsulosin or mirabegron treatment in healthy middle-aged to elderly men. Int J Clin Pharmacol Ther. 2014. doi:10.5414/CP201979
68. Debruyne FMJ, Jardin A, Colloi D, et al. Sustained-release alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. Eur Urol. 1998. doi:10.1159/000019706
69. Kirby RS, Roehrborn C, Boyle P, et al. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: The Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology. 2003. doi:10.1016/S0090-4295(02)02114-3
70. Oelke M, Bachmann A, Descazeaud A, et al. EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction. Eur Urol. 2013. doi:10.1016/j.eururo.2013.03.004
71. Kaplan SA, Roehrborn CG, Rovner ES, Carlsson M, Bavendam T, Guan Z. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder: A randomized controlled trial. J Am Med Assoc. 2006. doi:10.1001/jama.296.19.2319
72. Yang Y, Zhao XF, Li HZ, et al. Efficacy and safety of combined therapy with terazosin and tolteradine for patients with lower urinary tract symptoms associated with benign prostatic hyperplasia: A prospective study. Chin Med J (Engl). 2007. doi:10.1097/00029330-200703010-00004
73. Millin T. RETROPUBIC PROSTATECTOMY A NEW EXTRAVESICAL TECHNIQUE. REPORT ON 20 CASES. Lancet. 1945. doi:10.1016/S0140-6736(45)91030-0
74. Freyer PJ. TOTAL ENUCLEATION OF THE PROSTATE: A FURTHER SERIES OF 550 CASES OF THE OPERATION. BMJ. 1919. doi:10.1136/bmj.1.3031.121
75. Serretta V, Morgia G, Fondacaro L, et al. Open prostatectomy for benign prostatic enlargement in southern Europe in the late 1990s: A contemporary series of 1800 interventions. Urology. 2002. doi:10.1016/S0090-4295(02)01860-5
76. Naspro R, Suardi N, Salonia A, et al. Holmium Laser Enucleation of the Prostate Versus Open Prostatectomy for Prostates >70 g: 24-Month Follow-up. Eur Urol. 2006;50(3):563-568. doi:10.1016/j.eururo.2006.04.003
77. Martin HW. Cysto-Urethroscopic Resection of the Prostate. Cal West Med. 1932.
78. Mamoulakis C, Ubbink DT, de la Rosette JJMCH. Bipolar versus Monopolar Transurethral Resection of the Prostate: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Eur Urol. 2009. doi:10.1016/j.eururo.2009.06.037
79. Geavlete B, Georgescu D, Multescu R, Stanescu F, Jecu M, Geavlete P. Bipolar plasma vaporization vs monopolar and bipolar TURPA prospective, randomized, long-term comparison. Urology. 2011. doi:10.1016/j.urology.2011.03.072
80. Hai MA. Photoselective Vaporization of Prostate: Five-year Outcomes of Entire Clinic Patient Population. Urology. 2009. doi:10.1016/j.urology.2008.08.502
81. Sáez ID. Best surgical treatment for very large benign prostatic obstruction. World J Clin Urol. 2014;3(3):370. doi:10.5410/wjcu.v3.i3.370
82. Sandhu JS, Ng CK, Gonzalez RR, Kaplan SA, Te AE. Photoselective laser vaporization prostatectomy in men receiving anticoagulants. J Endourol. 2005. doi:10.1089/end.2005.19.1196
83. Chung DE, Wysock JS, Lee RK, Melamed SR, Kaplan SA, Te AE. Outcomes and complications after 532 nm laser prostatectomy in anticoagulated patients with benign prostatic hyperplasia. J Urol. 2011. doi:10.1016/j.juro.2011.04.068
84. Hiraoka Y. A new method of prostatectomy, transurethral detachment and resection of benign prostatic hyperplasia. J Nippon Med Sch. 1983;50(6):896-898. doi:10.1272/jnms1923.50.896
85. Fraundorfer MR, Gilling PJ. Holmium:YAG laser enucleation of the prostate combined with mechanical morcellation: Preliminary results. Eur Urol. 1998. doi:10.1159/000019535
86. Gilling PJ, Cass CB, Cresswell MD, Fraundorfer MR. Holmium laser resection of the prostate: Preliminary results of a new method for the treatment of benign prostatic hyperplasia. Urology. 1996. doi:10.1016/S0090-4295(99)80381-1
87. Herrmann TRW, Bach T, Imkamp F, et al. Thulium laser enucleation of the prostate (ThuLEP): transurethral anatomical prostatectomy with laser support. Introduction of a novel technique for the treatment of benign prostatic obstruction. World J Urol. 2010;28(1):45-51. doi:10.1007/s00345-009-0503-0
88. Gomez Sancha F. V44 GREENLEP, GREENLIGHT LASER ENUCLEATION OF THE PROSTATE. Eur Urol Suppl. 2010. doi:10.1016/s1569-9056(10)61081-0
89. Huet R, Baron M, Nouhaud F-X, et al. PD27-04 ENDOSCOPIC ENUCLEATION OF THE PROSTATE USING 532NM GREEN LASER (GREENLEP) COMPARED TO HOLMIUM LASER SYSTEM (HOLEP): MULTICENTER EVALUATION OF THE LEARNING CURVE IN THE SURGICAL TREATMENT OF BENIGN PROSTATE OBSTRUCTION. J Urol. 2017. doi:10.1016/j.juro.2017.02.1225
90. Neill MG, Gilling PJ, Kennett KM, et al. Randomized trial comparing holmium laser enucleation of prostate with plasmakinetic enucleation of prostate for treatment of benign prostatic hyperplasia. Urology. 2006. doi:10.1016/j.urology.2006.06.021
91. Gilling P, Reuther R, Kahokehr A, Fraundorfer M. Aquablation – Image-guided robot-assisted waterjet ablation of the prostate: Initial clinical experience. BJU Int. 2016. doi:10.1111/bju.13358
92. Hwang EC, Jung JH, Borofsky M, Kim MH, Dahm P. Aquablation of the prostate for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia. Cochrane Database Syst Rev. 2019. doi:10.1002/14651858.CD013143.pub2
