Capítulo 7
Introducción a la cirugía robótica
- Dr. M. Kerkebe L., Dr. M. Hassi R., Dr. S. Orellana S., Dr. N. Orellana S.
- Hospital DIPRECA
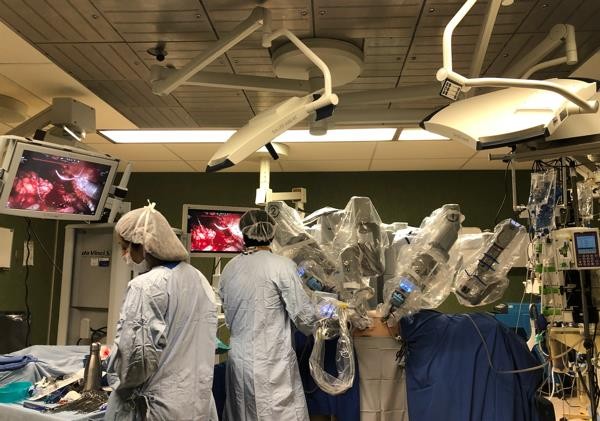
La cirugía robótica dejó de ser algo experimental y del futuro hace años. Actualmente se posiciona como el gold estándar para distintos tipos de procedimientos en los países desarrollados y, en los últimos 10 años, ha tenido un auge en el resto del mundo(1). A la fecha, son más de siete millones las cirugías realizadas, más de 43.000 cirujanos robóticos formados y el equipo se encuentra presente en más de 4.400 establecimientos, repartidos entre 67 países. Cada 26 segundos, comienza una cirugía con Sistema da Vinci en algún lugar del mundo(2).
En Chile, son ocho los establecimientos con el Sistema da Vinci® (Intuitive Surgical, Sunnyvale, CA), siendo Concepción, la única ciudad fuera de Santiago que cuenta con esta tecnología. (Fig.1-2)
Este equipo, ofrece ventajas como la visión tridimensional (3D), aumento de hasta 10x, escala de movimientos y filtración de temblores, lo cual permite al cirujano desarrollar cirugías complejas con mejores resultados para los pacientes, además de una curva de aprendizaje considerablemente menor en comparación a la técnica laparoscópica convencional.
En el mundo se proyecta un crecimiento de la cirugía robótica a una tasa anual del 10,4%, con un alza en inversiones de USD$ 3.9 mil millones en 2018 a USD$ 6.5 mil millones para el 2023(3). Es por esto, que el urólogo tiene que estar familiarizado con esta técnica quirúrgica y su conocimiento debe ser parte de la formación actual.
Historia
El primer uso documentado de un procedimiento quirúrgico asistido por robot ocurrió en 1985 cuando el brazo quirúrgico robótico PUMA 560 se usó en una biopsia neuroquirúrgica.
En 1988, Sir John Wickham y Brain Davis, en el Imperial College de Londres, demostraron la viabilidad de la resección transuretral de próstata (RTU-P) en un laboratorio con PUMA 560, siendo la primera cirugía robótica urológica. Desde entonces, se han desarrollado múltiples sistemas robóticos, como por ejemplo el sistema Zeus.
Con este, se realizó la primera cirugía robótica remota completa, el 7 de septiembre de 2001. La cirugía fue una colecistectomía transatlántica, efectuada por el cirujano francés Jacques Marescaux desde Estrasburgo, Francia y el paciente ubicado en Nueva York, a 6.230 km de distancia. A esta cirugía se le llamó la “Operación Lindbergh”, en honor al primer vuelo transatlántico de Charles Lindbergh desde Nueva York a París. France Telecom proporcionó la tecnología de fibra óptica, a fin de minimizar la latencia y optimizar la conectividad(4).
A pesar del desarrollo de múltiples sistemas robóticos, ninguno logró establecerse para comenzar su utilización de manera masiva y comercial.
Fue el año 2000 que el Sistema de Cirugía da Vinci® (Intuitive Surgical, Sunnyvale, CA), abrió nuevos caminos al convertirse en el primer sistema de cirugía robótica aprobado por la FDA para la cirugía laparoscópica general, iniciando la segunda generación de urología mínimamente invasiva.
En Chile, la cirugía robótica llegó el año 2009 a la Clínica Indisa, donde se crea el primer Centro de Cirugía Robótica del país, liderado por el Dr. Octavio Castillo.
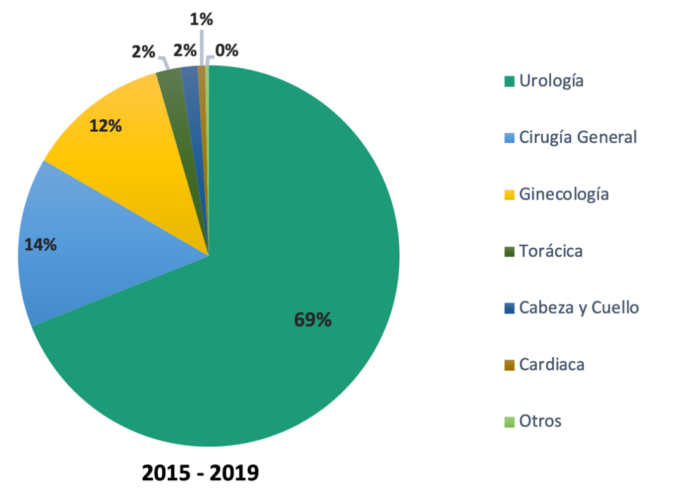
Al igual que en la experiencia mundial, en Chile es la urología la especialidad que más procedimientos realiza, representando aproximadamente el 70% de las cirugías robóticas chilenas (Fig. 3).
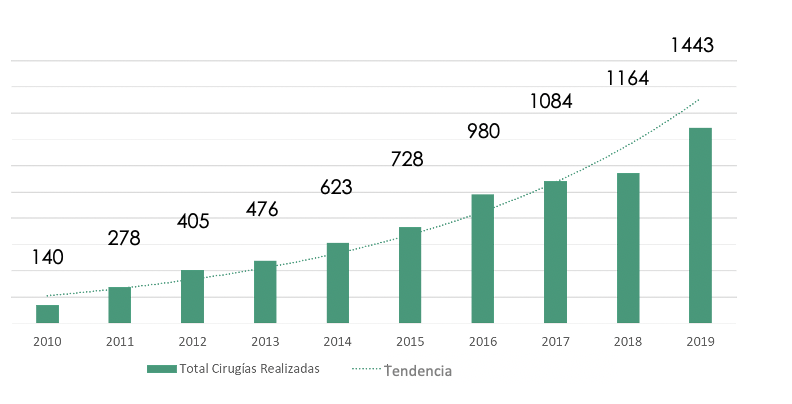
En urología, se utiliza principalmente en el área de la oncología y la cirugía reconstructiva, lo cual ha generado un gran impacto en la urología chilena durante los últimos años, transformando a nuestro país en pionero en el desarrollo de la técnica en la región. Esto se refleja en la cantidad de procedimientos y urólogos capacitados en cirugía robótica, los cuales aumentan año a año, siendo más de 40 los especialistas formados en Chile (Figura 4).

Fig.1. Modelos da Vinci.




Componentes del sistema robótico
El sistema robótico más implementado en el mundo es el Sistema da Vinci, existiendo cinco generaciones de éste, con prácticamente los mismos componentes, pero funciones más avanzadas de acuerdo con el año de lanzamiento.
Analizaremos las tres partes básicas de este sistema robótico, entendiendo que existen diferencias entre los modelos(5).
Consola de mando
Lugar donde el cirujano principal, sin ropa estéril, controla los movimientos de cuatro brazos. Tres con instrumentos cambiables y un cuarto de cámara. Esta consola es móvil, por lo que se puede posicionar en distintos sitios dentro del pabellón.
La consola, a su vez, está constituida por tres partes: controles de mando, sistema de visión y pedales.
Controles de mando, formados por dos pares de anillos, en los cuales se introducen los dedos en forma de pinza. Estos tienen un rango de movimiento de 540 grados y el instrumento robótico replica los movimientos realizados por el cirujano. Tiene un botón llamado “finger clash”, que permite liberar el control para así acomodar las manos y seguir trabajando cómodamente. Además, al mantener presionado el pedal de cámara, se logra dar foco, girando ambos controles de anillos.
El sistema de visión lo compone un binocular con visión tridimensional (3D), gracias a dos ópticas en paralelo, que forman la cámara robótica. El sistema procesa ambas imágenes (derecha e izquierda) y genera la imagen 3D. Destacar que el sistema permite el cambio entre visión (ojo) derecho e izquierdo, útil en momentos donde se altera la visión y no es posible retirar la cámara para su limpieza.
El sistema de pedales está conformado por un pedal para manejar la cámara, otro llamado “master clash”, el cual libera los controles de acción para así acomodarse libremente, un tercer pedal llamado “arm swap pedal”, el cual facilita el cambio entre brazos, permitiendo la utilización del tercer brazo alternadamente y dos pedales dobles, uno para cada brazo activo, los que activan la energía de corte o coagulación para cada instrumento.




Carro robótico
Robot propiamente tal, con tres brazos de instrumentos y un cuarto para la cámara, sobre una base móvil. En los brazos, se posicionan los instrumentos a utilizar, por puertos de 8mm, a excepción del brazo de cámara, que ingresa por un puerto de 12mm. Los brazos robóticos replicarán los movimientos del cirujano desde la consola, de manera exacta, comunicándose entre ellos por un sistema de cables. Futuras generaciones, probablemente, incorporarán comunicación inalámbrica.


Torre de laparoscopía
Como toda cirugía laparoscópica, es necesario contar con un insuflador para generar el neumoperitoneo, consola de energía y de un monitor bidimensional para que el ayudante vea la cirugía. Cabe destacar que esta pantalla es touch y permite la realización de marcaciones que se verán en la consola del cirujano, siendo esta una excelente herramienta para el aprendizaje de la técnica.


Comparación sistemas da Vinci Si / X / Xi
Características del Sistema según modelo:
| Característica | Da Vinci Si | Da Vinci X | da Vinci Xi |
| Instalación de puerto lineal | – | | |
| Movimiento de mesa integrado | – | – | |
| Rotación de la pluma | – | – | |
| Acceso multicuadrante | – | – | |
| Configuración guiada | – | – | |
| Ajustes intraoperatorios simplificados | – | – | |
| Posición de carro flexible | – | – | |
| Acceso lateral óptimo al paciente | – | – | |
Tecnología disponible según modelo:
| Característica | Da Vinci Si | Da Vinci X | da Vinci Xi |
| Instrumentos y endoscopio de cuarta generación | – | | |
| Energía integrada | – | | |
| Instrumento Stapler 30 | – | | |
| Instrumento Stapler 45 | * | | |
| Instrumento sellador de vasos (Vessel Sealer) | * | | |
| Imágenes con fluorescencia firefly | * | | |
| Sitio único | | | |
-
- : Disponible
– : No Disponible
* : Opcional
Sistema da Vinci Single Port (SP)
El interés en la reducción de la morbilidad asociada a la utilización de múltiples incisiones, llevó a la descripción de la cirugía laparoscópica con puerto único, incluyendo la colposacropexia, nefrectomía y orquiectomía(6-7). Sin embargo, dificultades técnicas asociadas a la restricción en la triangulación de los instrumentos, mala ergonomía y la necesidad de un equipo laparoscópico especializado limitó la masificación de la cirugía laparoscópica de puerto único.
En 2018, la FDA aprobó el Sistema da Vinci Single-Port (SP) para el uso en pacientes urológicos. La seguridad de esta plataforma para cirugías en humanos fue descrita en un estudio clínico fase II y desde su aprobación, se han publicado diversos reportes de casos que describen con éxito la realización de distintas cirugías urológicas como reimplante ureteral, prostatectomías (transperitoneal, extraperitoneal y perineal), nefrectomías radicales, nefrectomías parciales, nefroureterectomias, nefrectomía en donantes y cistectomías(8-14).
Sistema SP:
La plataforma SP comparte múltiples funciones con las plataformas multipuerto anteriores (modelo S, Si y Xi) para crear una experiencia familiar para los cirujanos robóticos que utilizan el modelo multipuerto. La plataforma SP utiliza la misma interfaz operativa, que incluye la tecnología Endowrist®, visualización tridimensional de alta definición con visión aumentada, movimiento a escala y reducción del temblor.
Esta plataforma utiliza un solo brazo quirúrgico para colocar una cámara flexible articulada de 8mm y tres instrumentos articulados de 6mm a través de una sola guía de entrada de 27mm (Fig. 12). Cada instrumento ocupa una posición a lo largo del “reloj” (3, 6, 9 y 12 en punto) (Fig. 13), es intercambiable y puede moverse dentro del trócar independiente de los demás. La incorporación de una cámara flexible representa un avance fundamental respecto a las plataformas multipuertos anteriores, ya que permite moverse en distintos planos y una segunda articulación genera que la cámara se flexione en todas las direcciones.
Otra característica de esta plataforma es que requiere de una mayor coordinación entre los instrumentos y la cámara, para compensar el área de trabajo y el campo de visión, los cuales son más pequeños. El navigator es una nueva superposición visual para el cirujano que le permite monitorizar la posición de cada instrumento y de la cámara en tiempo real. Al ser una imagen virtual, el navigator permite al cirujano rastrear instrumentos que pueden estar fuera de la visión de la cámara. Además, proporciona advertencias visuales adicionales a medida que los instrumentos alcanzan sus límites de movimiento. Finalmente, el sistema también ayuda al cirujano a identificar el posicionamiento óptimo de la cámara y los instrumentos para un paso quirúrgico determinado al identificar el “modo cobra”, en el que la cámara está en la línea media y se flexiona aproximadamente en 30º con una visión general de los instrumentos.




Enfoque técnico y modificaciones:
Otra modificación incluye la colocación del trócar robótico simple a través de una plataforma de acceso avanzado GelPOINT® para evitar la presión del brazo robótico sobre la piel del paciente, mejorar el sellado del aire y permitir la reubicación del trocar completo.
La nueva geometría de los instrumentos robóticos y la cámara crean un espacio de trabajo y un campo visual más pequeño, limitando la fuerza lateral de los instrumentos. Estas limitaciones pueden restringir la tracción o la sutura en comparación con el sistema multipuerto.
Además, la cámara flexible permite el ajuste continuo y el reajuste de la perspectiva visual, por lo que requiere una utilización más activa de la cámara, pero evita el cambio de múltiples ópticas laparoscópicas (0º y 30º).
Si bien el sistema SP se anuncia como una tecnología quirúrgica de un solo sitio, la mayoría de las operaciones requieren un asistente quirúrgico junto al paciente para intercambiar instrumentos, succionar, retraer y aplicar clips vasculares.
Generalmente se utiliza un puerto de 5mm a 5-6cm lateral al trócar principal para usarse como puerto auxiliar.
Para intentar solucionar la incorporación de un trócar auxiliar se han reportado varias propuestas novedosas, incluido el uso de una sonda nasogástrica flexible que pasa junto al trócar robótico y que el cirujano puede manipular desde la consola(15).
La plataforma SP proporciona un nuevo enfoque para las técnicas laparoscópicas o robóticas de puerto único y ha demostrado ser un enfoque factible para todo tipo de cirugías urológicas. Si bien aún se requieren estudios comparativos para evaluar los resultados operatorios a largo plazo entre las plataformas SP y multipuerto, los avances tecnológicos adicionales continuarán llevando a los cirujanos hacia enfoques quirúrgicos menos invasivos.
Desarrollando un programa de cirugía robótica
La incorporación de un robot quirúrgico, en cualquier institución, requiere el diseño de un plan bien estructurado para garantizar la implementación exitosa de un programa de cirugía robótica (CR).
Un diseño e implementación programada permiten que se cumplan los objetivos establecidos. El programa tiene que ser desarrollado en etapas. Una primera fase de planeación, luego ejecución, y por último, centrarse en el mantenimiento y el crecimiento para maximizar los beneficios del programa robótico.
Debido a los costos iniciales asociados a la CR, un modelo económico es esencial cuando se inicia un programa robótico. El desarrollo del plan de negocios requiere una evaluación de los costos directos (como la compra del robot) y del material asociado, junto al reclutamiento del personal y/o la capacitación de éste. Se debe establecer un pabellón de cirugía robótica, siendo posible la realización de modificaciones para soportar el equipo robótico completo. Un elemento importante para considerar es el reclutamiento, idealmente, de un cirujano robótico líder, en lugar de entrenar a uno desde cero. Esto permite reducir tiempos de implementación y desarrollo, reduciendo los costos del programa.
Un estudio de la comunidad, las posibles instituciones competidoras que comparten el mercado y el análisis de reembolsos y pagadores, según previsión de salud, son también elementos para analizar.
Contar con el volumen quirúrgico adecuado, es clave para el éxito. Este no sólo garantiza la factibilidad financiera del programa, sino que también permite la adquisición de experiencia necesaria para generar mejores resultados. Asegurar un número mínimo de cirugías al momento de comenzar el programa es crucial para el aprendizaje de la técnica.
Para desarrollar el programa, son necesarios los siguientes actores dentro del pabellón: cirujano principal, equipo de anestesia, cirujano asistente, equipo de arsenalera y enfermera de robótica. La experiencia del primer cirujano es clave en los tiempos de implementación del programa. Junto a él, el cirujano asistente debe conocer la técnica para asegurar una cooperación oportuna y eficiente entre la consola y la mesa de cirugía. Al igual que el cirujano de consola, el asistente desempeña un papel importante en la educación de los nuevos cirujanos. Es importante generar un equipo unido para el desarrollo del programa, entendiendo que existirán dificultades inherentes a la implementación y que serán solucionadas con el tiempo. Además, es necesario llevar un registro de los tiempos y resultados durante el desarrollo del programa: tiempos de posición de trócares, de docking y tiempos de consola. Estos tiempos, junto a los resultados oncológicos y funcionales, permitirán ir validando el programa y establecer metas para su perfeccionamiento(16).
Técnicas insignia de la cirugía robótica
Desde su introducción, la cirugía asistida por robot ha tenido un desarrollo exponencial, siendo la uro-oncología, el área más desarrollada. A la fecha, se han registrado grandes aumentos en el número de prostatectomías radicales, nefrectomías parciales y cistectomías radicales asistidas por robot.
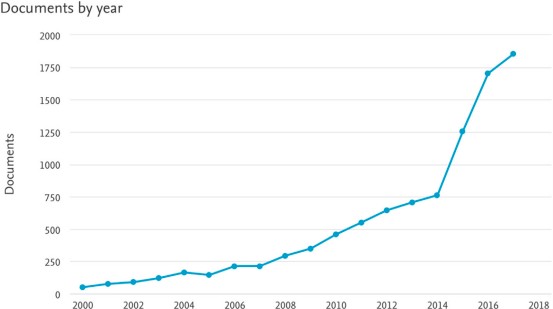
En la actualidad, en países desarrollados, sobre el 90% de estas cirugías se realizan con técnica robótica. A esto se le suma un aumento explosivo en la literatura científica sobre cirugía asistida por robot (Figura 9), llegando a un aumento anual superior al 100%(17).
Sorprendentemente, la investigación sobre el beneficio clínico en relación con la cirugía abierta ha producido evidencia heterogénea. A pesar de las múltiples investigaciones observacionales que informan una menor morbilidad perioperatoria a favor de la cirugía robótica, el único estudio aleatorizado no mostró diferencias significativas(18). Ante esto, se han presentado muchos argumentos para explicar esta controversia, como, por ejemplo, el sesgo de selección de pacientes candidatos a cirugía robótica en la fase de reclutamiento, factor clave a considerar al momento de evaluar los resultados un estudio observacional(19).

Prostatectomía radical robótica (RARP):
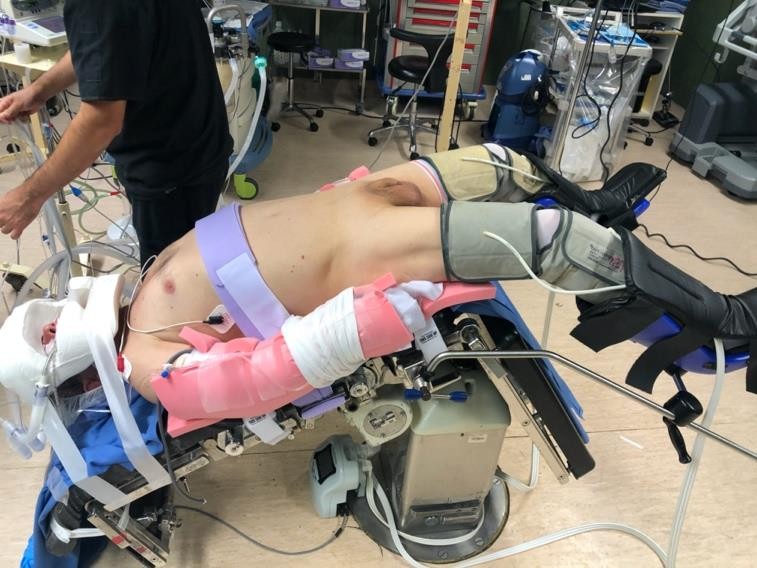
En la RARP, la experiencia y preferencia del cirujano son factores claves en la elección de la técnica quirúrgica. Actualmente existen diversas técnicas para realizar la RARP, siendo las de mayor preferencia la técnica transperitoneal con abordaje anterior y luego el abordaje posterior. Cualquiera sea el abordaje, la posición del paciente debe ser siempre en posición de Trendelenburg forzado a 25-30º (Figura 10).
Se introducen tres trócares robóticos de 8mm y dos trócares de 12mm (uno para la cámara y otro para el ayudante, pudiendo agregar un tercero para ayudante). El abordaje anterior permite el reconocimiento y abordaje inmediato de la vejiga y la próstata desde una visión superior, al igual que en las prostatectomías abiertas retro-púbicas. Este enfoque se adapta tanto a la cirugía laparoscópica convencional como a la robótica, ya sea trans o extraperitoneal(9) (Figura 11).
La técnica se inicia con el descenso de la vejiga, y la completa disección del espacio de Retzius hasta exponer por completo la cara anterior de la próstata. Luego, después de abrir o no la fascia endopélvica, se realiza una incisión en el cuello vesical, avanzando hacia posterior hasta acceder a las vesículas seminales para disecarlas y liberarlas en su totalidad(9). Por otro lado, el abordaje posterior comienza con el abordaje directo de las vesículas seminales a través de una incisión transversal del fondo de saco de Douglas. Luego se realiza la disección entre la próstata y el recto. Una vez liberado el recto, se procede con el abordaje anterior.
Actualmente, la mayoría de los equipos prefieren el abordaje transperitoneal vs. el abordaje extraperitoneal, debido a que el abordaje transperitoneal crea un mayor espacio para el Da Vinci y permite, con un solo abordaje, completar la prostatectomía y la linfadenectomía en caso de ser necesaria (ver Video 1).
Finalmente, la elección de la técnica ya sea anterior o posterior, no influye en la posición de los trócares ni en la duración del procedimiento quirúrgico. No existen estudios prospectivos aleatorizados que muestren diferencias en los resultados funcionales ni oncológicos entre ambas técnicas.



Prostatectomía radical robótica vs. prostatectomía radical abierta
En cuanto a la literatura internacional, existe sólo un estudio prospectivo, randomizado fase 3 publicado en la revista The Lancet por Yaxley et al.(18)
Este estudio randomizó pacientes con cáncer de próstata localizado a prostatectomía radical asistida por robot (RARP; n = 157) o prostatectomía radical abierta (ORP; n= 151). Las RARP fueron realizadas por un cirujano con experiencia de 200 casos y las ORP por un cirujano con 1500 casos.
Los resultados primarios fueron la función urinaria y función sexual (EPIC), registrados a las 6 semanas, 12 semanas y 24 meses. Además, se evaluaron los márgenes quirúrgicos, recidiva bioquímica y progresión en imágenes. Las puntuaciones de la función urinaria y sexual no difirieron entre ambos grupos, a las 6 y 12 semanas. No hubo diferencias significativas en cuanto a márgenes positivos (10% vs 15% p= 0.21). El tiempo quirúrgico fue inferior para las RARP, con menos eventos adversos intraoperatorios (8% vs 2%; p = 0.02). El sangrado fue menor en el brazo RARP, con un promedio de 895 ml (p <0.001). La duración de la estadía hospitalaria fue menor en 1.7 días (p <0.001) con una fuerte tendencia a menos complicaciones postoperatorias para el grupo RARP (9% vs 4%, p = 0.051)(19).
Aunque RARP y ORP parecen similares al evaluar los resultados finales de las puntuaciones funcionales, hubo áreas en las que RARP superó a ORP que incluyeron pérdida de sangre, tiempo quirúrgico, eventos adversos intrapabellón, estadía hospitalaria y dolor.
La cirugía asistida por robot logró superar los resultados quirúrgicos de un cirujano con más de 15 años de experiencia y sobre 1300 casos. Las nuevas publicaciones, de cirujanos con alta experiencia en cirugía robótica, han mostrado resultados superiores a la técnica abierta. Un ejemplo de esto son los resultados publicados por Cohelo et al., con la técnica de liberación retrógrada de las bandeletas neurovasculares con preservación del complejo venoso dorsal, donde el 85,9% de los pacientes quedó continente de inmediato y el 98,4% estaban continentes a un año. A un mes después de la operación, 60 pacientes estaban potentes (53%), mientras que 98 de 113 pacientes (86%), lograban potencia a un año(21).
Experiencia en robótica en Chile
La primera prostatectomía radical robótica en Chile fue realizada en enero de 2010 por el Dr. Octavio Castillo con el Sistema DaVinci S(5). Posteriormente se incorporaron más sistemas robóticos a otros centros logrando un desarrollo exponencial, realizándose al día de hoy más de 400 prostatectomías robóticas al año.
La primera publicación realizada en Chile fue en 2011 por el grupo del Dr. Castillo, quien comunicó los primero 50 casos con el Sistema DaVinci S, donde la mediana del tiempo quirúrgico fue de 199 minutos. El sangrado medio estimado fue de 666 ml (50-4.000 ml). La media de estadía hospitalaria y el tiempo de sonda fueron de 2 y 6 días, respectivamente. La tasa de continencia y de potencia inmediata fue de 88,3% y 33,3%, respectivamente. Al comparar los 25 casos iniciales versus los 25 finales hubo un descenso significativo en el tiempo quirúrgico y sangrado estimado (254 minutos vs. 189 minutos y 876 ml vs. 467 ml, respectivamente). También se encontró una menor tasa de márgenes positivos en el grupo 2 (20% vs 12%). El análisis estadístico determinó la curva de aprendizaje en 40 procedimientos(5).
Publicaciones más recientes sobre prostatectomía radical robótica en centros chilenos
Clínica Alemana publicó 500 pacientes operados de PRR con el Sistema DaVinci Si entre septiembre de 2012 y agosto 2017. El tiempo quirúrgico promedio fue de 157 minutos (70-290), sangrado promedio de 350ml (100-1600). Márgenes positivos 22%. Recuperación de la continencia en un 95.7% y función erectil 92.3% de los pacientes(22).
El grupo de Clínica Santa María publicó su serie entre enero de 2016 y agosto de 2018 con 216 pacientes operados. El tiempo quirúrgico fue de 208 minutos (78 – 510), sangrado 340cc (50 – 1500). Márgenes positivos de 16.2%. 79% de continencia total 22.
El grupo de la Fundación Arturo López Pérez publicó sus resultados con la técnica de conservación de la fascia endopélvica, complejo venoso dorsal y preservación neurovascular. Entre octubre 2016 y diciembre 2017 se realizaron 48 prostatectomías radicales robóticas. El tiempo operatorio fue de 143 minutos (105– 245). La hospitalización fue de un día en todos los pacientes. El sangrado promedio fue de 100ml (50-200 ml). Tasa de márgenes positivos 18,75%. El 73% tuvo continencia inmediata y un 98% al mes. Del grupo, el 85% fue potente al año(22).
En cuanto al grupo de Hospital DIPRECA, se publicaron recientemente los primeros 150 casos. Se analizaron los datos en forma retrospectiva de los primeros 150 pacientes consecutivos sometidos a RARP (Grupo I: casos 1–50; Grupo II: casos 51–100; Grupo III: casos 101– 150). El tiempo de la consola RARP se redujo gradualmente del Grupo I al Grupo III (268 min, 203min, 165 min respectivamente, p<0.001). La pérdida de sangre disminuyó del grupo I al grupo III, (590 cc, 500 cc, 409 cc respectivamente. p=0.014). Los márgenes quirúrgicos positivos fueron del 26%, 6%, y 8% en pT2 en los grupos I, II y III, respectivamente(23).
La RARP realizada en centros chilenos, ha mostrado resultados similares a la literatura internacional (Tabla 1), y sin duda, mejores resultados que la cirugía abierta si lo comparamos con la literatura nacional. En ella, encontramos en prostatectomía radical abierta un porcentaje de margen quirúrgico que va del 21% al 32%. Si bien actualmente en Chile no existen trabajos que comparen ambas técnicas, creemos que la cirugía robótica es una alternativa válida e incluso con mejores resultados oncológicos que la técnica abierta en la realidad nacional.


Tabla 1. Experiencia nacional publicada en prostatectomía radical abierta.
Nefrectomía parcial robótica
La nefrectomía parcial (NP) representa el gold standard para el tratamiento de masas renales <4 cm (cT1a). Algunos estudios respaldan la indicación ampliada de NP en pacientes seleccionados con tumores de 4 a 7 cm (cT1b) e incluso más grandes (cT2)(24).
Esta cirugía puede realizarse mediante técnicas tradicionales o mínimamente invasivas, como la laparoscopía convencional o la cirugía asistida por robot.
La nefrectomía parcial laparoscópica (LPN) es un procedimiento técnicamente exigente, con una curva de aprendizaje lenta. Por esta razón, la Asociación Europea de Urología (EAU) propone el tratamiento laparoscópico como un tratamiento opcional para los tumores renales cT1 sólo en centros altamente experimentados.
La nefrectomía parcial asistida por robot (RAPN) representa la evolución de la LPN; de hecho, en muchos centros especializados ha reemplazado completamente a la cirugía abierta y laparoscópica. La primera serie RAPN fue reportada por Getman et al. en 2004(24). Gracias a la cirugía robótica, el cirujano logra realizar una resección tumoral subcapsular precisa. Además, la renorrafia se realiza fácilmente, simplificando la reconstrucción del parénquima y acelerando las maniobras para lograr una hemostasia adecuada, maximizando la preservación de tejido renal sano. Gracias a esto, actualmente se realizan resecciones de tumores renales mayores de 4 cm y cada vez más complejos. Weinberg et al. en un estudio poblacional mostró que la adquisición de un robot se asocia a un mayor uso de cirugía conservadora de nefronas(25). Respecto a la técnica quirúrgica, la RAPN es similar a la técnica laparoscópica en cuanto a la posición del paciente y la técnica propiamente tal.



Otra ventaja de la cirugía robótica por sobre otras técnicas es la menor complejidad para realizar la nefrectomía parcial retroperitoneal. Sobre la técnica, son claves el posicionamiento del puerto de cámara y la creación del espacio retroperitoneal. Para esto, se marca la cresta ilíaca, las costillas y la línea axilar anterior. Se identifica el triángulo de Petit (compuesto por la cresta ilíaca inferiormente, el dorsal ancho posterior y el oblicuo externo anterior), el cual sirve como un hito anatómico importante.
Se realiza una incisión de 12–15 mm de longitud para el puerto de cámara, a 2cm (1 ancho de dedo) sobre la cresta ilíaca, justo lateral al triángulo de Petit. Los músculos oblicuos externos se separan mediante retractores para exponer la fascia lumbodorsal. Con ayuda de una pinza de Kelly, se penetra la fascia y se accede al espacio retroperitoneal. El dedo índice se inserta en este espacio. Uno debería poder sentir la punta de la costilla 12, el músculo psoas y, a veces, el polo inferior del riñón. Usando una disección suave de dedos, romo, el peritoneo es cuidadosamente desplazado. Luego se inserta, idealmente, un balón dilatador para generar el espacio.
Posteriormente se inserta la óptica por el trócar del globo y se comienza a insuflar creando el espacio retroperitoneal al expandirse el globo bajo visión directa. El globo se desinfla y se reemplaza con un puerto de 12 mm para la cámara robótica.
La posición del puerto de cámara dentro del espacio retroperitoneal es crucial, ya que todas las demás ubicaciones de los puertos se basan en esto. Todos los puertos deben colocarse con al menos 8 cm de espacio entre ellos. Las mediciones finales no se toman hasta que se haya creado el neumo-retroperitoneo.
El trócar robótico lateral se inserta primero, a 8 cm superior y lateral al puerto de cámara, en el espacio debajo de la 12a costilla. A continuación, se marcan los sitios de puerto robótico medial y auxiliar de 12 mm. El puerto auxiliar se coloca en la línea axilar anterior, justo cefálica a la espina ilíaca superior anterior, 8 cm caudal al puerto robótico medial. También se puede usar un cuarto brazo, especialmente en los casos en que la grasa perinéfrica es abundante. La ventaja del cuarto brazo es la elevación del riñón usando un ProGrasp™, liberando así los otros dos instrumentos robóticos.
Una vez acoplados, se insertan los instrumentos robóticos (brazo derecho, tijeras monopolares; brazo izquierdo, pinza bipolar fenestrada). El primer paso es el manejo de la grasa paranéfrica. Esta se diseca cuidadosamente de la fascia de Gerota. A continuación, se practica una incisión en la fascia de Gerota justo por encima del músculo psoas, exponiendo la grasa y el riñón. Una vez que se identifican los vasos hiliares, el resto de la operación sigue los pasos estándar de una nefrectomía parcial robótica, mejorando considerablemente el acceso a tumores posteriores o en pacientes donde el abordaje transperitoneal se prefiera evitar (Ver video 2 y 3).
Nefrectomía Parcial Robótica en Chile
Sobre nefrectomía parcial robótica (NPR), las primeras series publicadas en Chile son las de Clinica INDISA y HOSDIP. La primera, fue publicada por el grupo del Dr. Castillo, con 25 pacientes consecutivos sometidos a NPR desde abril de 2010 a febrero de 2011. Utilizó el sistema robótico da Vinci S, con abordaje transperitoneal. El tiempo operatorio promedio fue de 117,6 minutos (54-205) y el tiempo de isquemia caliente fue de 20,2 minutos (9-34). El sangrado estimado promedio fue de 440 ml (20-2.000). El tamaño tumoral promedio fue de 3,25 cm (1-5,3). No hubo conversión a cirugía abierta o laparoscópica. La estancia media hospitalaria fue de 3,5 días (1-7). No hubo márgenes quirúrgicos positivos ni mortalidad(26).
HOSDIP por su parte presentó una cohorte de sus primeros 85 pacientes entre junio de 2014 y diciembre de 2018. Se compararon los resultados en cada cirugía, según la complejidad técnica del tumor basado en el R.E.N.A.L score (baja, mediana y alta complejidad). Se incluyeron 57 pacientes con diagnóstico de cáncer renal. El tamaño tumoral promedio fue de 3,5±1,9cm, siendo en el 33,3% de los casos considerado de baja, 54,4% de mediana y 12,3% alta complejidad. Globalmente, en el 89,5% de las NPR el tiempo de isquemia fue menor de 25 minutos y no hubo complicaciones ClavienDindo mayor o igual a 2 en el 92,9%. Los márgenes quirúrgicos fueron negativos en el 96,5% de los casos. Con un seguimiento promedio de 17±10meses, el 77,2% y el 98,2%, preserva a lo menos el 90% de su VFG y se encuentra libre de recurrencia local o a distancia, respectivamente. En el 63,2% de los casos se logró el cumplimiento de todas las variables de la pentafecta. Al comparar cada variable entre los grupos según complejidad técnica (baja, mediana y alta) no hubo diferencias estadísticamente significativas(27).
La introducción de la cirugía robótica ha permitido extender las indicaciones de nefrectomía parcial, siendo una alternativa segura frente a la nefrectomía radical. Hoy en día podemos incluir a aquellos pacientes con tumores considerados técnicamente complejos, ofreciéndoles un tratamiento quirúrgico con excelentes resultados oncológicos, quirúrgicos y funcionales.
Nuevas plataformas
El 2020 será un año interesante para la cirugía robótica. Finalizan licencias y se lanzan nuevos modelos, tanto laparoscópicos como endoscópicos. Procedemos a detallar los lanzamientos más interesantes que vendrán(28).
Alternativas disponibles al Sistema DaVinci:
1) Telelap ALF-X: Diseñado por la compañía Sofar (Milán, Italia). Cuenta con una estación de control remota y tres brazos robóticos montados en tres carros separados. El dispositivo tiene una pantalla 3D HD que necesita lentes polarizados para la visualización en 3D HD. Dos mandos similares al mango de una pinza laparoscópica manipulan los instrumentos, diseñados por Tuebingen Scientific (Tubingen, Alemania), basados en la tecnología Radius. Las características únicas del sistema son la presencia de sensación háptica y un sistema de eye-tracking. Ver detalles.

2) Medtronic: El año 2015 Medtronic compró Covidien, comenzando el desarrollo de un prototipo realizado en 2010 llamado MicroSurge. Este consiste en tres brazos robóticos separados en una mesa quirúrgica y una estación de control remota. Esta plataforma pretendía ser lanzada a fines del año 2019. Probablemente el año 2020 contaremos con ella.

3) Avatera: Desde 2012, Avateramedical (Jena, Alemania) junto con Force Dimension (Nyon, Suiza) y con Tuebingen Scientific (Tubingen, Alemania) se encuentran diseñando una consola integrada a un monitor con tecnología tipo microscopio para una imagen 3D con resolución full HD. Cuatro brazos robóticos montados en un carro. Su proceso de validación comenzó en 2017. Ver detalles.


4) Revo-i: Robot creado con la colaboración de la Universidad de Yonsei y otros académicos coreanos. Meercompany (Hwasong, Coréa) diseñó este modelo, el cual consiste en una consola y un carro de 4 brazos robóticos unidos, muy similar al Sistema daVinci. Su patente se registró en 2014. En 2016 se hicieron los primero estudios en animales y actualmente se encuentra a la venta. Ya se encuentran publicados los primeros trabajos de uso en humanos, con prostatectomías radicales.Ver detalles.


Sistemas robóticos en endourología
1) Avicenna Roboflex: Surge en Turquía, donde se diseñó un robot para la cirugía retrógrada intrarrenal (RIRS) con una consola y elemento de trabajo. En el “Avicenna Roboflex”, el cirujano controla la pieza de mano del ureteroscopio flexible con dos controles de mando, con los movimientos de deflexión/flexión, avance y rotación. Cuenta con pedales integrados para la activación de la fluoroscopía y láser. Además, puedes controlar la posición de la fibra y la irrigación(29-30).


2) Aquablation: En EE.UU. se lanzó la cirugía por ablación de adenoma prostático. Esta consiste en un chorro de agua a alta presión, asistida por robot (Aquablation, Procept, Redwood Shores, Estados Unidos). Este nuevo sistema, muestra una eficacia significativa en comparación con la resección transuretral estándar(31).


3) Sensei – Magelan: Otro ejemplo de sistema robótico no laparoscópico es la ureteroscopía flexible robótica. Esta utiliza un sistema Sensei-Magelan (Hansen Medical, Mountain View, EE. UU.) Este equipo fue diseñado para cardiología por Frederick Moll, el inventor del Sistema da Vinci. Este dispositivo consta de cuatro componentes: consola de cirujanos, sistema de catéter flexible, sistema de manipulación de catéter remoto y una estructura que contiene hardware de computadora, fuentes de alimentación y unidades de fuente de video. El sistema robótico de catéter flexible consiste en una funda de catéter externa (14/12F) y una guía de catéter interna (12/10F). Se inserta un ureteroscopio flexible de fibra óptica 7.5F a través de la guía del catéter interno. La manipulación remota del sistema de catéter maniobra la punta del ureteroscopio, que va junto a la guía interna generando una manipulación pasivamente del instrumento(32).


Costos y beneficios de los nuevos robots
Se espera que los costos para los nuevos robots sean significativamente más bajos, con un rango de alrededor de 800,000 USD en comparación con 2.1 USD para el sistema Da Vinci XI. Intuitive Surgical ya ha reaccionado implementando el sistema X entre el SI y el XI para seguir controlando el mercado. La variedad de nuevos dispositivos robóticos tendrá un impacto importante en los costos, incluida la compra y el mantenimiento del robot, así como los precios de los instrumentos.
El desarrollo de la tecnología robótica nunca se detendrá e intentará ofrecer cada vez más beneficios, tanto al cirujano como al paciente, al menor costo posible(33).
Conclusiones
La cirugía robótica es un técnica instalada y resuelve un sinnúmero de limitaciones de la cirugía laparoscópica tradicional, ofreciendo ventajas considerables sobre esta, como la mejoría en los rangos de movimientos, facilitación de la cirugía en zonas estrechas, eliminación del temblor y postura ergonómica del cirujano. Además, suturas menos complejas y una visión tridimensional con imagen de alta calidad, generando un cambio en los límites de la cirugía convencional.
Las innovaciones tecnológicas, que avanzan día a día, irán trayendo cambios a los actuales equipos, lo cual probablemente generará cambios en los procedimientos quirúrgicos actuales. Esto permitirá en el futuro la realización masiva de técnicas complejas, menores tiempos de aprendizaje, mejores resultados quirúrgicos y la implementación global de la telecirugía. Esto conllevará nuevos problemas éticos y legales sobre la responsabilidad médica, los cuales deberán ser resueltos en el futuro, sin dejar de lado que la relación médico paciente, nunca debe abandonarse.
Bibliografía
- Diffusion of robotic-assisted laparoscopic technology across specialties: a national study from 2008 to 2013. Yen-Yi Juo, Aditya Manth, Ahmad Abiri Anne Lin, Erik Dutson.
- https://www.intuitive.com/en-us/about-us/company
- https://www.marketsandmarkets.com/Market-Reports/surgical-robots- market-256618532.html
- Shah J, Vyas A, Vyas D. The History of Robotics in Surgical Specialties. Am J Robot Surg. 2014;1(1):12–20. doi:10.1166/ajrs.2014.1006
- Octavio A. Castillo C., Ivar Vidal M. Unidad de Urología y Centro de Cirugía Robótica, Clínica Indisa. Santiago, Chile. Cirugía robótica.
- Kaouk JH, Haber GP, Goel RK, Desai MM, Aron M, Rackley RR, Moore C, Gill IS (2008) Single-port laparoscopic surgery in urology: initial experience. Urology 71(1):3–6. https ://doi.org/10.1016/j.urolo gy.2007.11.034.
- Rane A, Rao P, Rao P (2008) Single-port-access nephrectomy and other laparoscopic urologic procedures using a novel laparoscopic port (R-port). Urology 72(2):260–263. https ://doi.org/10.1016/j.urolo gy.2008.01.078 (discussion 263-4).
- Dobbs RW, Magnan BP, Abhyankar N, Hemal AK, Challacombe B, Hu J, Dasgupta P, Porpiglia F, Crivellaro S (2017) Cost effectiveness and robot-assisted urologic surgery: does it make dollars and sense? Minerva Urol Nefrol 69(4):313–323. https ://doi.org/10.23736 /S0393 -2249.16.02866 -6.
- Kaouk J, Garisto J, Bertolo R (2019) Robotic urologic surgical interventions performed with the single port dedicated platform: first clinical investigation. Eur Urol 75(4):684–691. https://doi. org/10.1016/j.eururo.2018.11.044.
- LaMattina JC, Alvarez-Casas J, Lu I, Powell JM, Sultan S, Phelan MW, Barth RN (2018) Robotic-assisted single-port donor nephrectomy using the da Vinci single-site platform. J Surg Res 222:34–38. https://doi.org/10.1016/j.jss.2017.09.049.
- Gaboardi F, Pini G, Suardi N, Montorsi F, Passaretti G, Smelzo S (2019) Robotic laparoendoscopic single-site radical prosta- tectomy (R-LESS-RP) with daVinci Single-Site(R) platform. Concept and evolution of the technique following an IDEAL phase 1. J Robot Surg 13(2):215–226. https://doi.org/10.1007/ s11701-018-0839-9.
- Hebert KJ, Joseph J, Gettman M, Tollefson M, Frank I, Viers BR (2019) Technical considerations of single port ureteroneo- cystostomy utilizing da Vinci SP platform. Urology. https://doi. org/10.1016/j.urology.2019.03.020
- Agarwal DK, Sharma V, Toussi A, Viers BR, Tollefson MK, Gett- man MT, Frank I (2019) Initial experience with da Vinci single- port robot-assisted radical prostatectomies. Eur Urol. https://doi. org/10.1016/j.eururo.2019.04.001.
- Kaouk JH, Bertolo R (2019) Single-site robotic platform in clinical practice: first cases in the USA. Minerva Urol Nefrol 71(3):294–298. https://doi.org/10.23736/S0393-2249.19.03384-8.
- Hebert KJ, Joseph J, Gettman M, Tollefson M, Frank I, Viers BR (2019) Technical considerations of single port ureteroneo- cystostomy utilizing da Vinci SP platform. Urology. https://doi. org/10.1016/j.urology.2019.03.020.
- PalmerKJ,LoweGJ,CoughlinGD,PatilN,PatelVR. Launching a successful robotic surgery program. J Endourol. 2008;22(4):819-824.
- Mottrie A, Larcher A, Patel V. The Past, the Present, and the Future of Robotic Urology: Robot-assisted Surgery and Human-assisted Robots. Eur Urol Focus. 2018 Oct 15;4(5):629–31.
- Yaxley JW, Coughlin GD, Chambers SK, Occhipinti S, Samaratunga H, Zajdlewicz L, et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: early outcomes from a randomised controlled phase 3 study. Lancet. 2016 Sep 10;388(10049):1057–66.
- Kasabwala K, Patel NA, Hu JC. Review of optimal techniques for robotic- assisted radical prostatectomy. Curr Opin Urol. 2018;28(2):102–7.
- van Poppel H, Everaerts W, Tosco L, Joniau S. Open and robotic radical prostatectomy. Asian Journal of Urology. 2019 Apr;6(2):125–8.
- de Carvalho PA, Barbosa JABA, Guglielmetti GB, Cordeiro MD, Rocco B, Nahas WC, et al. Retrograde Release of the Neurovascular Bundle with Preservation of Dorsal Venous Complex During Robot-assisted Radical Prostatectomy: Optimizing Functional Outcomes. Eur Urol. 2018 Jul 21;
- Revista Chilena de Urología. Volumen 84 | Número 4 año 2019. Editorial. Editorial Número 4 año 2019.
- Narvaez P, Orellana S, Hassi M, Kerkebe M, Orellana N. IMPACTO DEL SISTEMA ROBÓTICO DA VINCI EN PROSTATECTOMÍA RADICAL EN UN CENTRO DEL SERVICIO PÚBLICO CHILENO. XXXVIII Congreso de la Confederación Americana de Urología (CAU). 2019.
- Gettman, M. T., Blute, M. L., Chow, G. K., Neururer, R., Bartsch, G., & Peschel, R. (2004). Robotic-assisted laparoscopic partial nephrectomy: technique and initial clinical experience with DaVinci robotic system. Urology, 64(5), 914-918.
- Weinberg, A. C., Wright, J. D., Whalen, M. J., Paulucci, D. J., Woldu, S. L., Berger, S. A., … & Badani, K. K. (2016). Use of partial nephrectomy after acquisition of a surgical robot: A population based study. Urology practice, 3(6), 430-436.
- Castillo OA, Rodríguez-Carlin A, López-Fontana G, Vidal-Mora I, Gómez I R. Nefrectomía parcial robótica: experiencia inicial en 25 casos consecutivos. Actas Urológicas Españolas. 2012 Jan;36(1):15–20.
- Vera A, Hassi M, Orellana S, Orellana N, Kerkebe M.RESULTADOS DE NEFRECTOMIA PARCIAL ASISTIDA POR ROBOT SEGÚN COMPLEJIDAD QUIRURGICA. XXXVIII congreso de la Confederación Americana de Urología (CAU). 2019.
- Brodie A, Vasdev N. The future of robotic surgery. Ann R Coll Surg Engl. 2018;100(Suppl 7):4‐13. doi:10.1308/rcsann.supp2.4.
- Kaouk, J. H., Haber, G. P., Autorino, R., Crouzet, S., Ouzzane, A., Flamand, V., & Villers, A. (2014). A novel robotic system for single-port urologic surgery: first clinical investigation. European urology, 66(6), 1033-1043.
- Saglam R, Muslumanoglu AY, Tokatlı Z, et al. A new robot for flexible ureteroscopy: development and early clinical results (IDEAL stage 1-2b). Eur Urol. 2014;66:1092–100.
- Gilling P, Reuther R, Kahokehr A, Fraundorfer M. Aquablation—image- guided robot-assisted water- jet ablation. BJU Int. 2016;117:923–9.
- Desai MM, Grover R, Aron M, et al. Robotic flexible ureteroscopy for renal calculi: initial clinical experince. J Urol. 2011;186:563–8.
- Robotic Urology, Third Edition. Hubert Jhon, Peter Wiklund. 2018.
