Capítulo 33
Uso de Pet CT en urología
- Dr. Camilo Sandoval H. Dr. Jaime Altamirano P.
- Fundación Arturo López Pérez
Introducción
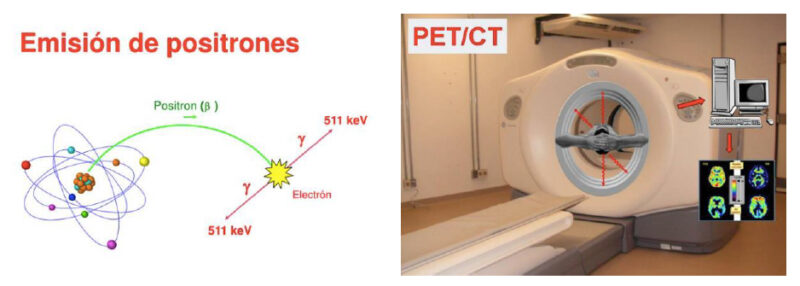
La tomografía por emisión de positrones se basa en el fenómeno físico determinado por la emisión de ondas electromagnéticas que generan los radioisótopos y que pueden ser medidos por una gama cámara. En el momento de decaer, un isotopo radioactivo libera un positrón (carga positiva) que al unirse a un electrón (carga negativa) libera un fotón emitiendo radiación gama. Esta emisión puede ser medida por receptores de una gama cámara. Esto produce cambios en los cristales de la cámara que a su vez se transforma en datos medibles por software que convierte la información en imágenes
Desde el punto de vista biológico, en esta técnica se agrega químicamente un ion radioactivo a una molécula con metabolización o afinidad especifica por un tejido existiendo distintos grados de afinidad y captación. La gama cámara es capaz de medir la intensidad de la emisión según el área del cuerpo. La cantidad de emisión tiene una relación directa con la captación del marcador en los distintos tejidos, esta intensidad de emisión se representa en la unidad de captación estándar o standarized uptake value (S.U.V).
El fenómeno de la emisión de positrones se ha estudiado en medicina desde los años 60. Es posible complementar la información del PET con las imágenes adquiridas con el uso de una tomografía computarizada. Al aplicar estas técnicas logramos una imagen sumada que permite combinar el detalle anatómico con la información de la captación de diferentes marcadores.
Distintos isotopos han sido utilizados para marcar moléculas, Fluor 18, Galio 68 y Carbono 11 entre otros. La molécula más utilizada para lograr un marcador biológicamente útil es fluor deoxiglucosa(FDG) en la cual se marca una molécula de glucosa con flúor 18 la que se administra por vía endovenosa en el paciente. Al estar marcada determina una captación aumentada del flúor 18 por los tejidos con mayor captación de glucosa. El mayor metabolismo glucídico del tejido neoplásico permite detectar la mayor emisión en estos tejidos. La mayor emisión permite por un lado detectar su presencia y también inferir su nivel de metabolismo o absorción de glucosa y por ende definir el nivel de actividad celular independiente del aspecto anatómico. Este fenómeno permite determinar el grado de respuesta de un tejido a los tratamientos utilizados.
Dado que el metabolismo glucídico de los tejidos neoplásicos no es estándar entre distintas patologías, otras moléculas han sido desarrolladas como marcadores. Tal es el caso del Dotatate Galio para tumores neuroendocrinos. Actualmente existen diferentes moléculas que están en estudio con la intención de obtener marcadores más específicos y al mismo tiempo sensibles para distintos tejidos.
El uso de esta tecnología de imágenes ha contribuido en el diagnostico y manejo de patología oncológica en general. En urología se ha incorporado con distintos grados de utilidad en el manejo de los tumores más frecuentes. El objetivo de este capítulo es realizar una revisión de la utilidad del PET en urología oncológica.

Cáncer de Riñón
El carcinoma renal de células claras corresponde a la histología más frecuente en los cánceres de riñón. La principal herramienta de estudio diagnóstico es la Tomografía axial computada. El Pet -CT tiene poca utilidad agregada en el diagnóstico debido a que la mayoría de los isotopos utilizados tienen una excreción renal lo que impide una adecuada visualización, sumado a que el tejido renal sano tiene gran captación de glucosa en forma normal. Esto determina que la captación que pueda tener el tejido neoplásico hace difícil diferenciarlo del parénquima normal. Diferentes publicaciones han demostrado la heterogeneidad de los tumores de células claras destacando una baja avidez por la glucosa (1). Finalmente, la emisión de positrones contribuye poco a la imagen tomográfica.
En el estudio de metástasis el PET FDG 18 glucosa tiene una mayor utilidad permitiendo reconocer lesiones en forma precoz o lesiones pequeñas indeterminadas. La mayoría tiene un metabolismo glucídico irregular. En tumores más indiferenciados la captación de glucosa marcada puede llegar a ser muy alta, pero esta situación no es estándar. En Carcinomas de células renales es habitual que tengan una captación de glucosa similar a los tejidos sanos. Tomado esto en consideración el uso regular del PET-CT no permite tomar decisiones en relación a la presencia de posibles metástasis más allá de lo información anatómica entregada por La tomografía convencional.
Probablemente, el mayor impacto se ha reportado en serie de casos, reportado por Ueno (2), observando una mejor tasa de sobrevida global y libre de progresión, en pacientes con una variación >20% SUV máx posterior al inicio de tratamiento con Inhibidores de Tirosina Kinasa.
El estudio de nuevos marcadores que puedan contribuir al estudio de carcinoma renal persiste, pero por el momento las guías internacionales no recomiendan su uso en forma regular
Cáncer de Urotelio
El carcinoma urotelial es la principal lesión neoplásica a nivel de vejiga y de trayecto urinario superior. Esta histología tiene un alto metabolismo glucídico por lo que la adquisición de FDG 18 glucosa es intensa. Lamentablemente el marcador tiene alta eliminación urinaria lo que determina que los estudios de la vejiga y del urotelio superior con PET-CT no den una buena sensibilidad en lesiones superficiales de la pelvis renal, el uréter y vejiga dado que pueden quedar ocultos por la gran emisión que determina la F-FDG presente en la orina. Las imágenes de las vejigas obtenidas por tomografía y actualmente por Resonancia nuclear magnética tienen mejor resolución y sensibilidad para lesiones superficiales (3). Esta característica determina que el PET no tenga mucha utilidad en el diagnostico precoz ni remplace a estudios invasivos como la cistoscopía para reconocer estadios iniciales de la enfermedad ni tampoco sea útil para realizar seguimiento de recidivas superficiales en la mucosa urotelial.
La principal ventaja de esta técnica está el en estudio de etapificación. La captación a nivel de adenopatías permite reconocer diseminación linfática precozmente. En el estudio más grande que compara el PET-CT glucosa a la tomografía computada se comparó la patología definitiva luego de 233 cistectomías radicales. En estas condiciones el PET es capaz de aumentar la sensibilidad para ganglios comprometidos desde un 45 a un 69% por sobre el TAC convencional. La captación de F-FDG además tuvo una sensibilidad del 54% versus el 41% para reconocer metástasis extrapelvianas (4).
Al reconocer un número mayor de lesiones ganglionares y extrapelvianas se puede definir mejor el pronóstico. En distintas series de casos reportados, la información del PET-CT permitió modificar la indicación de tratamiento en aproximadamente el 20% a 25% de los pacientes (5,6).
El PET-CT tiene además la ventaja de permitir reconocer el grado de respuesta al tratamiento con quimioterapia en paciente con metástasis. Además de los criterios anatómicos dados por reducción de tamaño de las adenopatías, la disminución de la captación de F-FDG 18 glucosa, permite reconocer el grado respuesta tisular a la terapia, gracias a la medición en la disminución del SUV luego la quimioterapia. Existe una buena correlación entre la respuesta metabólica al PET y los hallazgos finales de la histopatología (7). La Información del PET-Ct permite planear el tratamiento luego de una quimioterapia de inducción para definir el beneficio de una eventual cistectomía o definir la necesidad de más terapia sistémica.
Cáncer de Próstata
El cáncer de próstata es el cáncer más frecuente en la comunidad y existe una gama de terapias que permiten su manejo en distintos momentos de evolución de la enfermedad. Además de la utilidad del antígeno prostático, las imágenes cumplen un rol fundamental para su terapia y seguimiento. Una vez tratado el cáncer hasta un 30% de los pacientes pueden recurrir y las imágenes convencionales no son capaces de orientar eventuales tratamientos de rescate en forma precoz.
El adenocarcinoma de próstata tiene un metabolismo glucídico bajo de forma habitual, aunque se ha descrito que en tumores muy indiferenciados pueden captar en forma intensa, esta es una situación poco frecuente (8). La falta de captación de glucosa determina que el Pet convencional no tenga un rol en el estudio de esta patología, aunque sea el cáncer más frecuente en urología.
Desde hace años se han investigado diferentes moléculas y su captación a nivel del tejido tumoral de la próstata. Es así como se han incorporado dos marcadores para el estudio de la próstata basados en el principio de la tomografía por emisión de positrones.
PET Colina
El primer marcador incorporada en el estudio especifico de la próstata fue la C 11-Colina. Las moléculas de colina son ingresadas a las membranas celulares de las células y dado la gran celularidad del adenocarcinoma prostático, este tumor tiene gran avidez por el marcador. El isotopo radioactivo utilizado para la síntesis puede ser Carbono 11 o Flúor 18 con capacidades diagnósticas equivalentes pero una vida media más larga en el segundo, lo que facilita el uso en centros lejanos al lugar de producción, mejorando la disponibilidad y disminuyendo los costos.
En el tejido prostático hiperplásico benigno también puede existir una captación elevada del marcador, lo que conlleva a que el PET-Colina no tenga mucha utilidad para el diagnóstico inicial de cáncer en pacientes sospechosos. El principal uso ha estado en el estudio de diseminación en pacientes de alto riesgo y en la etapificación de pacientes tratados y evidencias de recidiva.
Para la definición de compromiso ganglionar el PET-Colina tiene una sensibilidad del 62% pero con una especificidad de hasta 96% (9). Si bien puede superar la sensibilidad de técnicas de imagen convencionales, no permite descartar el compromiso ganglionar por lo que no remplaza a la disección ganglionar, cuando está indicada.
En relación a la detección de metástasis a distancia la sensibilidad del PET-Colina no supera la detección por cintigrafía ósea pero si su especificidad, teniendo un rol en descartar lesiones inespecíficas al cintigrama.(10)
El principal uso del PET colina ha sido en el estudio de retapificación luego del tratamiento. En pacientes con recurrencia bioquímica esta tecnología ha permitido reconocer el foco de las recurrencias y así plantear eventuales tratamientos de rescate. La sensibilidad y especificidad dependen directamente del antígeno prostático. La sensibilidad llega a un 86% con un 96% de especificidad (11), pero disminuye a menos del 50% cuando el valor del antígeno prostático en menor a 2 ng/ml (12).
PET-PSMA
El antígeno específico de membrana prostática (PSMA) es una proteína transmembrana presente en distintos tejidos del cuerpo pero que tiene una sobre expresión en las células neoplásicas de la próstata. Al usar una molécula con afinidad por esta proteína y asociarla con un átomo de galio 68 o Flúor 18 se logra un marcador que tiene gran afinidad por las células neoplásicas de la próstata (13).
Este tipo de PET ha sido incorporado masivamente en el estudio del cáncer de próstata y ha sido utilizado tanto en el estudio de diseminación como en la retapificación post tratamiento.
El uso de PET PSMA rápidamente se incorporó en el estudio de pacientes con cáncer de próstata para evaluar la presencia de metástasis aumentado la sensibilidad por sobre el TAC convencional y el cintigrama óseo. La principal ventaja en relación al PET Colina es que ha demostrado mayor sensibilidad a niveles muy bajos de antígeno prostático, logrando una sensibilidad de 33% con antígenos tan bajos como 0.2 ng/ml. Comparativamente logra sensibilidades del 50% bajo 0,5 ng/ml versus solo el 12% del PET Colina a los mismos niveles (14). En el estudio pretratamiento inicial aumenta la posibilidad de detectar lesiones, pero el impacto en sobrevida no se ha demostrado en forma significativa (15).
La posibilidad de reconocer la ubicación de óligometástasis en pacientes con recurrencias bioquímicas ha permitido plantear tratamientos como linfadenectomías de rescate o radiocirugía de lesiones óseas focales. Estas terapias han tenido un rol en replantear la intensión curativa en pacientes que originalmente eran candidatos solo a terapia de deprivación androgénica. Los resultados de estas experiencias no han demostrado tasas elevadas de curación, pero si la prolongación de sobrevida libre de uso de terapia hormonal y aún está pendiente definir si en globo prolongaran la sobrevida (16).
Cáncer de Testículo
En el cáncer testicular tiene la capacidad de dar metástasis precozmente. En la detección de estas metástasis el PET FDG 18 glucosa no aporta mayor sensibilidad que el TAC convencional.
En pacientes con lesiones demostradas, la respuesta al tratamiento sistémico con quimioterapia es difícil de evaluar ya que los criterios anatómicos pueden no ser suficientes en el caso de masas residuales.
En el caso de los pacientes con seminoma puro como histología inicial y metástasis retroperitoneales tratadas con quimioterapia, la presencia de tejido neoplásico residual tiene una captación elevada de glucosa. En este escenario el PET FDG 18 glucosa permite tomar decisiones. En caso de adenopatías retroperitoneales post quimioterapia de más de 3 cm con ausencia de captación tiene un alto valor predictivo negativo, siempre y cuando las imágenes sean adquiridas por lo menos 8 semanas después de concluida la Quimioterapia. Por otro lado, el valor predictivo positivo ante captación elevada llega hasta el 96% (17).
En tumores testiculares no seminoma, el tejido remanente posterior a la quimioterapia puede ser heterogéneo. Por ejemplo, el tejido teratomatoso tiende a ser similar al tejido sano por lo que no es posible diferenciar tejido cicatricial residual post quimioterapia de tejido neoplásico viable. Esto determina que las imágenes del PET no permitan tomar decisiones de tratamientos.
Luego de la quimioterapia ante la presencia de masas residuales la recomendación es la resección por medio de una linfadenectomía lumboaortica dado que la ausencia de captación no permite descartar la presencia de neoplasia.
Cáncer de pene
En el cáncer de pene el compromiso ganglionar es precoz y de principal importancia para definir el pronóstico y diseñar el tratamiento. El examen clínico es capaz de reconocer lesiones ganglionares mayores. Ante la ausencia evidente de compromiso inguinal existe hasta un 25% de probabilidades de presencia de micrometástasis ganglionares según diversas series de linfadenectomía inguinal, inclusos el estudio con imágenes convencionales como Resonancia nuclear magnética y TAC no logra descartar la presencia de compromiso ganglionar (18).
Dado el riego de compromiso ganglionar las guías internacionales plantean la realización de una linfadenectomía en pacientes con riesgo de micrometástasis a pesar de tener estudio inguinal negativo.
Por la necesidad de mejorar el diagnostico el PET-CT glucosa ha sido utilizado para reconocer compromiso de ganglios inguinales. Tiene una gran especificidad y sensibilidad en lesiones de más de 10mm Lamentablemente el valor predictivo negativo en lesiones pequeñas no permite descartar el uso de la linfadenectomía en pacientes con alto riesgo de metástasis subclínicas. Pero en aquellos pacientes con adenopatías mayores a 10mm permite una adecuada valoración del compromiso ganglionar pelviano y a distancia (19).
Theranósticos
La medicina nuclear y el uso de la tomografía de emisión de positrones ha permitido una nueva aplicación en el manejo de la patología urológica más halla de estudio. El concepto theranóstico combina la capacidad diagnóstica del PET-CT con la posibilidad de realizar tratamientos basados en moléculas marcadas.
Se utiliza el mismo principio de unir un átomo radiactivo a una molécula con afinidad especial por el tejido neoplásico. Cuando el átomo utilizado tiene una capacidad de emisión de radiación más alta, se puede lograr un efecto terapéutico sobre el tejido blanco. Es fundamental que la molécula tenga una gran afinidad por los tejidos neoplásicos en forma especifica y no por tejidos sanos para asegurar que la radiación no dañe otros órganos.
Este principio ha sido utilizado en el tratamiento de cáncer de próstata metastásico. Se utiliza la misma molécula de PSMA a la que se le suma un átomo de fluor 18 para obtener una imagen de los tejidos blanco.
Una vez que se demuestra una buena afinidad de los tejidos neoplásicos por la molécula PSMA Fluor, se vuelve a utilizar la molécula, pero esta vez asociada a un átomo de lutecio 177. Este átomo radioactivo se concentra en el tejido ávido por la molécula marcadora. Dado el efecto radioactivo se puede lograr necrosis del tejido neoplásico respetando el resto de los órganos del individuo (20).
Esta terapia por el momento se ha reservado a pacientes que han fracasado a otras líneas de tratamiento gracias a que produce muy pocos efectos colaterales y una excelente paliación de dolores óseos. Es probable que en el futuro se convierta en una excelente opción para tratar las lesiones que podamos ver al PET.
Bibliografía
1.- Bertagna F, Motta F, Bertoli M et al. Role of F18-FDG-PET/CT in restaging patients affected by renal carcinoma. Nucl. Med. Rev. Cent. East. Eur. 2013; 16: 3–8.
2.- Ueno D, Yao M, Tateishi U, Minamimoto R, Makiyama K, Hayashi N et al. Early assessment by FDG-PET/CT of patients with advanced renal cell carcinoma treated with tyrosine kinase inhibitors is predictive of disease course. BMC Cancer 2012; 12:162-70.
3.-Nayak B, Dogra PN, Naswa N, Kumar R. Diuretic 18F-FDG PET/CT imag- ing for detection and locoregional staging of urinary bladder cancer: prospec- tive evaluation of a novel technique. Eur. J. Nucl. Med. Mol. Imaging 2013; 40: 386–93
4.-Goodfellow H, Viney Z, Hughes P et al. Role of fluorodeoxyglucose positron emission tomography (FDG PET)-computed tomography (CT) in the staging of bladder cancer. BJU Int. 2014; 114: 389–95.
5.-Mertens LS, Fioole-Bruining A, Vegt E, Vogel WV, van Rhijn BW, Horen- blas S. Impact of (18) F-fluorodeoxyglucose (FDG)-positron-emission tomog- raphy/computed tomography (PET/CT) on management of patients with carcinoma invading bladder muscle. BJU Int. 2013; 112: 729–34.
6.-Kollberg P, Almquist H, Blackberg M et al. [F]Fluorodeoxyglucose – posi- tron emission tomography/computed tomography improves staging in patients with high-risk muscle-invasive bladder cancer scheduled for radical cystec- tomy. Scand. J. Urol. 2015; 49: 296–301.
7.-Kollberg, P., Almquist, H., Bläckberg, M., Cwikiel, M., Gudjonsson, S., Lyttkens, K., … Liedberg, F. (2017). [18F]Fluorodeoxyglucose-positron emission tomography/computed tomography response evaluation can predict histological response at surgery after induction chemotherapy for oligometastatic bladder cancer. Scandinavian Journal of Urology, 51(4), 308–313.
8.-Jadvar H. Imaging evaluation of prostate cancer with 18F-fluorodeoxyglucose PET/CT: utility and limitations. Eur. J. Nucl. Med. Mol. Imaging 2013; 40 (Suppl 1): S5–10.
9.- Von Eyben, F.E., et al. Meta-analysis of (11)C-choline and (18)F-choline PET/CT for management of patients with prostate cancer. Nucl Med Commun, 2014. 35: 221
10.- Picchio, M., et al. [11C]Choline PET/CT detection of bone metastases in patients with PSA progression after primary treatment for prostate cancer: comparison with bone scintigraphy.
Eur J Nucl Med Mol Imaging, 2012. 39: 13.
11.-Evangelista L, Zattoni F, Guttilla A et al. Choline PET or PET/CT and bio- chemical relapse of prostate cancer: a systematic review and meta-analysis. Clin. Nucl. Med. 2013; 38: 305–14.
12.-Fanti S, Minozzi S, Castellucci P et al. PET/CT with (11)C-choline for evalu- ation of prostate cancer patients with biochemical recurrence: meta-analysis and critical review of available data. Eur. J. Nucl. Med. Mol. Imaging 2016; 43: 55–69.
13.-Heston WD. Characterization and glutamyl preferring carboxypeptidase function of prostate specific membrane antigen: a novel folate hydrolase. Urology. 1997; 49(suppl):104-112.
14.-Morigi JJ, Stricker PD, van Leeuwen PJ, et al. Prospective comparison of 18F-fluyoromethylcholine versus 68Ga-PSMA pET/CT in prostate cancer patients who have rising PSA after curative treatment and are being considered for targeted therapy. J Nucl Med. 2015;56:1185-1190.
15.- Eiber, M., et al. 68Ga-labeled Prostate-specific Membrane Antigen Positron Emission Tomography for Prostate Cancer Imaging: The New Kid on the Block-Early or Too Early to Draw Conclusions? Eur Urol, 2016. 70: 938.
16.- Ploussard, G., et al. Management of Node Only Recurrence after Primary Local Treatment for Prostate Cancer: A Systematic Review of the Literature. J Urol, 2015. 194: 983.
17.- De Santis, M., et al. 2-18fluoro-deoxy-D-glucose positron emission tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. J Clin Oncol, 2004. 22: 1034.
18.-Mueller-Lisse, U.G., et al. Functional imaging in penile cancer: PET/computed tomography, MRI, and sentinel lymph node biopsy. Curr Opin Urol, 2008. 18: 105.
19.-Sadeghi R, Gholami H, Zakavi SR, Kakhki VR, Horenblas S .Accuracy of 18F-FDG PET/CT for diagnosing inguinal lymph node involvement in penile squamous cell carcinoma: systematic review and meta-analysis of the literature.
. Clin Nucl Med. 2012 May; 37(5):436-41.
20.-Rahbar K, Ahmadzadehfar H, Kratochwil C, et al. German multicenter study investigating 177Lu-PSMA-617 radioligand therapy in advanced prostate cancer patients. J Nucl Med 2017; 58:85 – 90.
First report of safety and efficacy of a German multicenter retrospective study of patients undergoing 177Lu-PSMA-617.
